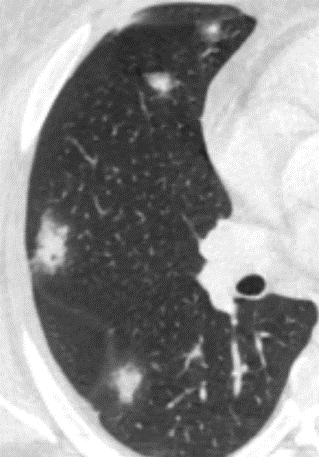
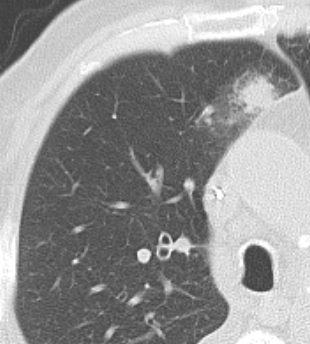
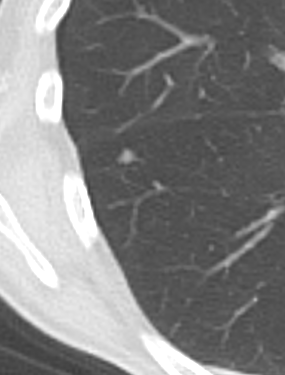
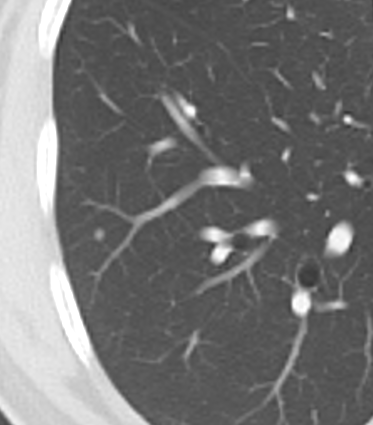
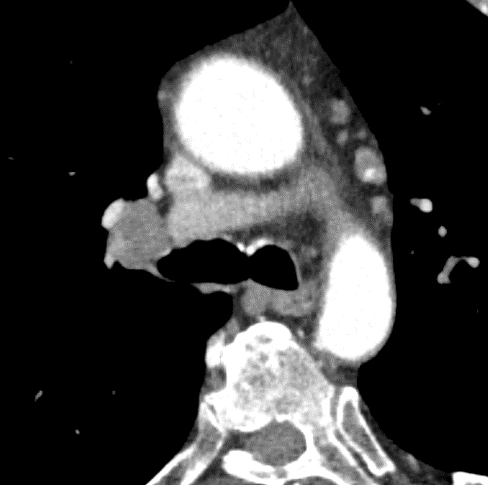
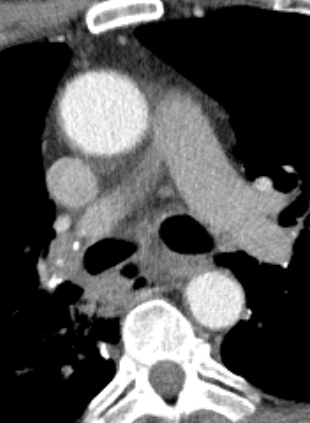
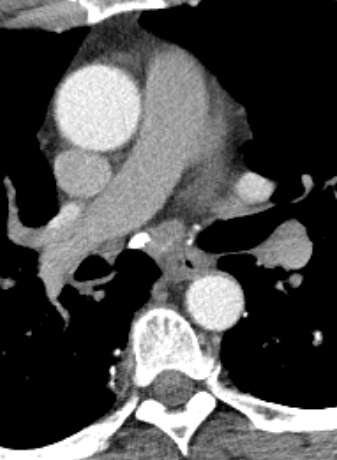
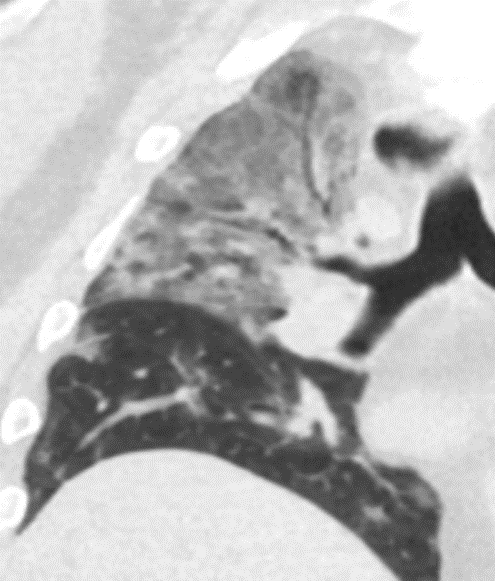1. Atelektase
2. Konsolidierung
3. Milchglasareal
4. Emphysem
5. Retikulation
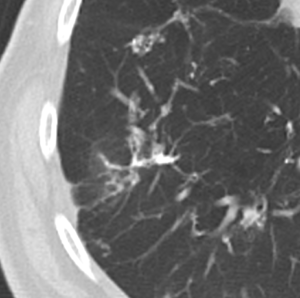
6. Kavitation
7. Raumforderung
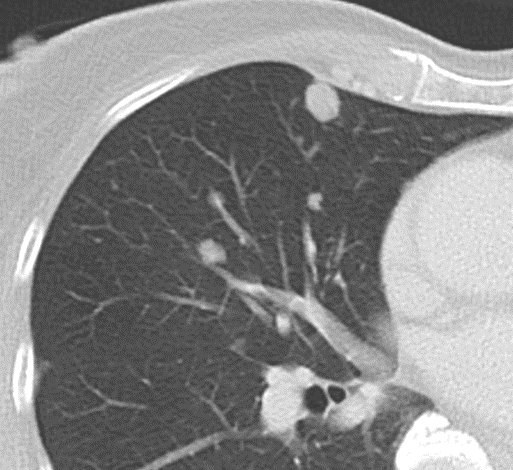
8. Rundherd
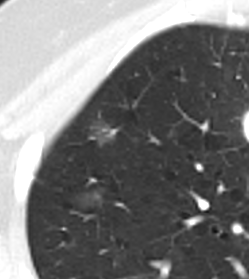
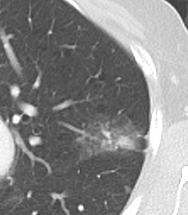
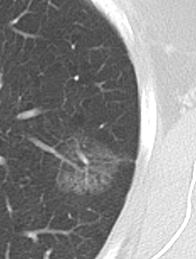
9. Nodulus <5mm
10. Bronchuswandverdickung
11. Bronchiektasen
12. Pneumothorax
13. Pleuraerguss
14. Pleuraerkrankung
15. Arterienverschluss
16. Truncus Pulmonalis
17. Lymphadenopathie
Sehr geehrte und liebe Kollegen/innen,
die strukturierte Befundung von 14.000 CT-Thoraxuntersuchungen im Rahmen von RACOON stellt ein beispielloses Mammutprojekt der deutschen Universitätsradiologien dar. Der Ihnen hiermit vorliegende Bildatlas wurde im Dezember und Januar 2020/21 von vielen fleißigen Helfern in Berlin und Erlangen zusammengetragen. Er soll den Befundern eine Hilfestellung sein, das zugegebenermaßen recht komplexe und nicht unbedingt selbsterklärende RACOON-Template zu verinnerlichen und die diesem zugrunde liegenden Überlegungen zu verstehen.
Erschrecken Sie bitte nicht wegen des Umfangs bzw. der Seitenzahl! Im Wesentlichen handelt es sich um ein typisch radiologisches Bilderbuch.
Das Template für die strukturierte Befundung wurde in Zusammenarbeit mit den Experten/innen der AG Thoraxdiagnostik der Deutschen Röntgengesellschaft entwickelt. Unser Ziel war es, übliche Thorax-Pathologien und radiologische Zeichen korrekt und möglichst isoliert voneinander zu identifizieren und diese dann reproduzierbar in einer einheitlichen Befundmaske registrieren zu können. Zu diesem Zweck wurde der Thorax zunächst in die fünf Kompartimente Lungenparenchym, Bronchien, Pleura, Gefäße und Mediastinum “zerlegt”. Während der strukturierten Befundung mit der MintLesion-Software werden diese Kompartimente bei jedem Fall nacheinander abgearbeitet und Sie werden Punkt für Punkt abgefragt, welche darin mögliche Pathologie wo in der Lunge und in welchem Schweregrad vorliegt.
Die verschiedenen Pathologien, insgesamt 17 an der Zahl, wurden auf Grundlage des aktuellen Glossars der Fleischner Society und der hervorragenden deutschen Überarbeitung von PD Wormanns aus Berlin und Prof. Hamer aus Regensburg definiert. Eine Lektüre der folgenden beiden Artikel möchten wir Ihnen dringend ans Herz legen, bevor Sie diesen Bildatlas verwenden und mit der strukturierten Befundung beginnen:
- Hansell at al, Fleischner Society: glossary of terms for thoracic imaging, Radiology. 2008 Mar;246(3):697-722.
- Wormanns / Hamer, Glossar thoraxradiologischer Begriffe entsprechend der Terminologie der Fleischner Society, Rofo. 2015 Aug;187(8):638-61.
Auf den ersten Seiten des Bildatlas werden wir in einem theoretischen Teil das Prinzip der strukturierten Befundung von Schweregrad und Verteilung der verschiedenen Pathologie erläutern. Den praktischen Hauptteil nimmt dahinter dann der eigentliche Atlas ein, in dem wir zahlreiche repräsentative Bildbeispiele versammelt haben. Die meisten Abbildungen haben wir aus unseren PACS-Archiven extrahiert, viele stammen aber auch aus verschiedensten Lehrbüchern, Online-Portalen, Zeitschriftenartikeln und Vorlesungen. Es wäre zu aufwendig gewesen, jede externe Quelle (wissenschaftlich) korrekt anzugeben. Daraus ergibt sich die dringende Bitte der Autoren, den RACOON-Atlas ausschließlich intern zu verwenden und ihn nicht unkritisch an Dritte weiterzugeben bzw. Ihn gar als Quelle zu zitieren.
Der RACOON-Atlas ist ein dynamisch wachsendes Projekt. Kontinuierlich werden wir etwaige Missverständnisse und Fehler korrigieren und fragwürdige Abbildungen gegen bessere ersetzen. Eventuell folgen in den nächsten Wochen und Monaten noch eine ausführlichere Auflistung von Literaturempfehlungen und ein FAQ-Teil. Über konstruktives Feed-Back würden wir uns jederzeit freuen.
Dr. med. Felix Döllinger & Priv.-Doz. Dr. med. Matthias May,
Berlin & Erlangen im Januar 2021
Version: v3.0 2023-04-19
Matthias S May1, Theresa Rüttinger1, Lisa Siegler1, Andreas Bucher2, Tobias Penzkofer3, Saif Afat4, Marwin Sähn5, Nora Lubina6, David Schraudt7, Marcel Eicke8, Thomas Vogl2, Bernd Hamm3, Felix Döllinger3
1: Universitätsklinikum Erlangen, Radiologisches Institut, Ulmenweg 18, 91056 Erlangen
2: Universitätsklinikum Frankfurt, Institut für Diagnostische und Interventionelle Radiologie, Theodor-Stern-Kai 7, 60590 Frankfurt
3: Charité Universitätsmedizin Berlin, Klinik für Radiologie, Charitéplatz 1, 10117 Berlin
4: Universitätsklinikum Tübingen, Department für Radiologie, Hoppe-Seyler-Straße 3, 72076 Tübingen
5: Uniklinik RWTH Aachen, Klinik für Diagnostische und Interventionelle Radiologie, Pauwelsstraße 30, 52074 Aachen
6: Universitätsklinikum Augsburg, Klinik für Diagnostische und Interventionelle Radiologie und Neuroradiologie, Stenglinstraße 2, 86156 Augsburg
7: Uniklinikum Würzburg, Institut für Diagnostische und Interventionelle Radiologie, Oberdürrbacher Straße 6, 97080 Würzburg
8: Medizinische Hochschule Hannover, Institut für Diagnostische und Interventionelle Radiologie, Carl-Neuberg-Straße 1, 30625 Hannover
I. Theorie
- Die Angabe von Lokalisation und Schweregrad der verschiedenen Pathologien ist das Herzstück der strukturierten Lungenbefundung im Rahmen von RACOON.
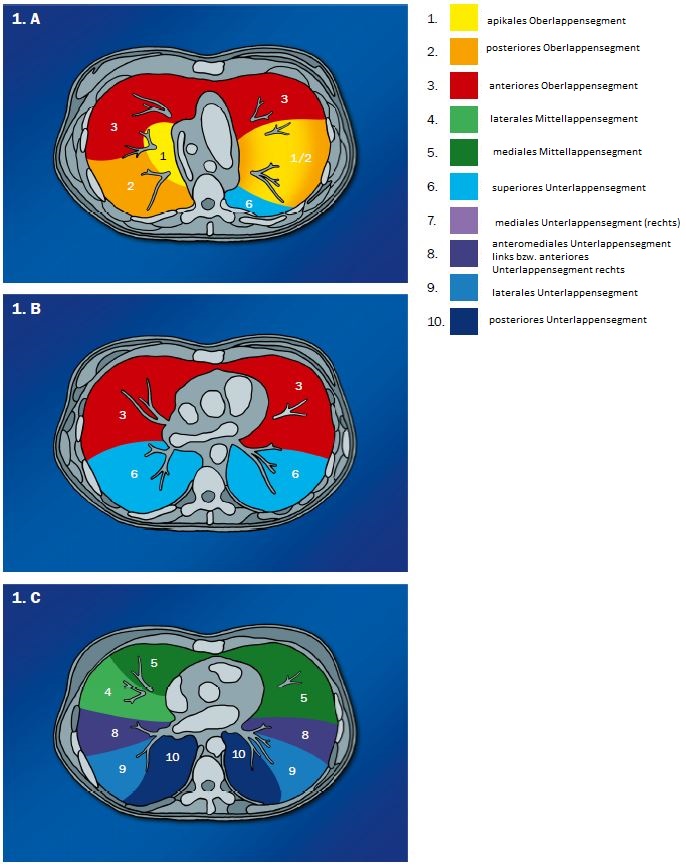
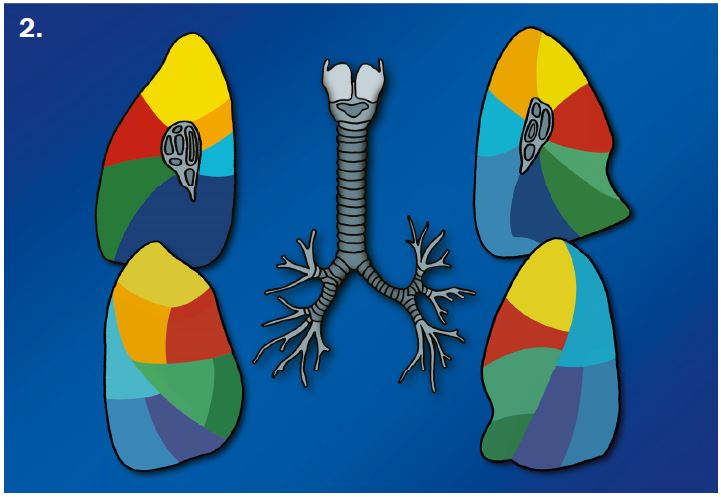
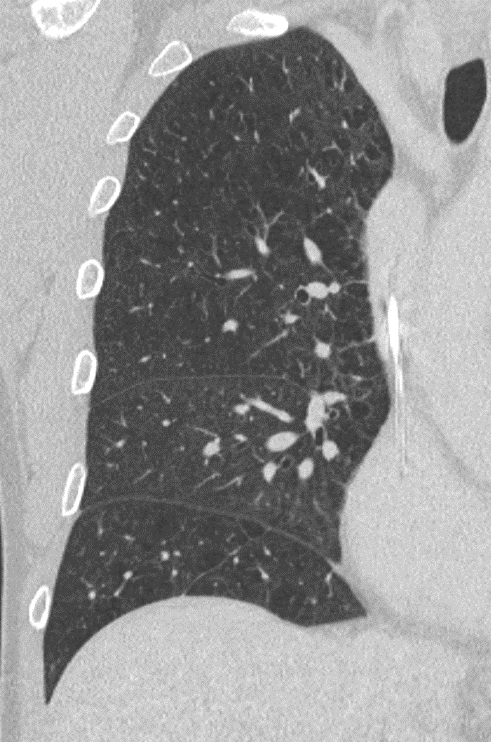
- Der Schweregrad der pulmonalen und bronchialen Pathologien wird für jeden Lappen einzeln beurteilt. Wir gehen dabei von 6 Lappen aus, betrachten die Lingula also als eigenen Lappen.
- Der Schweregrad der vier flächig ausgeprägten pulmonalen Pathologien Atelektase, Konsolidierung, Milchglasareal und Retikulationen wird in den folgenden vier Graden eingeteilt:
- nicht vorhanden (0)
- subsegmental (1)
- segmental (2)
- mehrsegmental bis lobär (3)
- Wenn ein Lappen bzgl. einer Pathologie beurteilt wird, lohnt sich die Betrachtung in verschiedenen Raumebenen. Der/die Befunder/in muss dann nämlich abschätzen, wie viel Volumen dieses Lappens insgesamt von der gerade beurteilten Pathologie betroffen ist.
- Ganz bewusst wurde sich bei der Erstellung des RACOON-Templates dagegen entschieden, den Schweregrad anhand prozentualer Schwellen einzuteilen, also anhand von Dritteln, Vierteln o.ä. Unsere Beobachtungseinheit ist stattdessen das Lungensegment. Versuchen Sie bei der strukturierten Befundung also abzuschätzen, wie viel Volumen des gerade beurteilten Lappens insgesamt betroffen ist.
- Weniger als das Volumen eines einzelnen Segments? Subsegmental (1).
- Insgesamt etwa das Volumen eines einzelnen Segments? Segmental (2).
- Definitiv mehr als das Volumen eines einzelnen Segments? Mehrsegmental bis lobär (3).
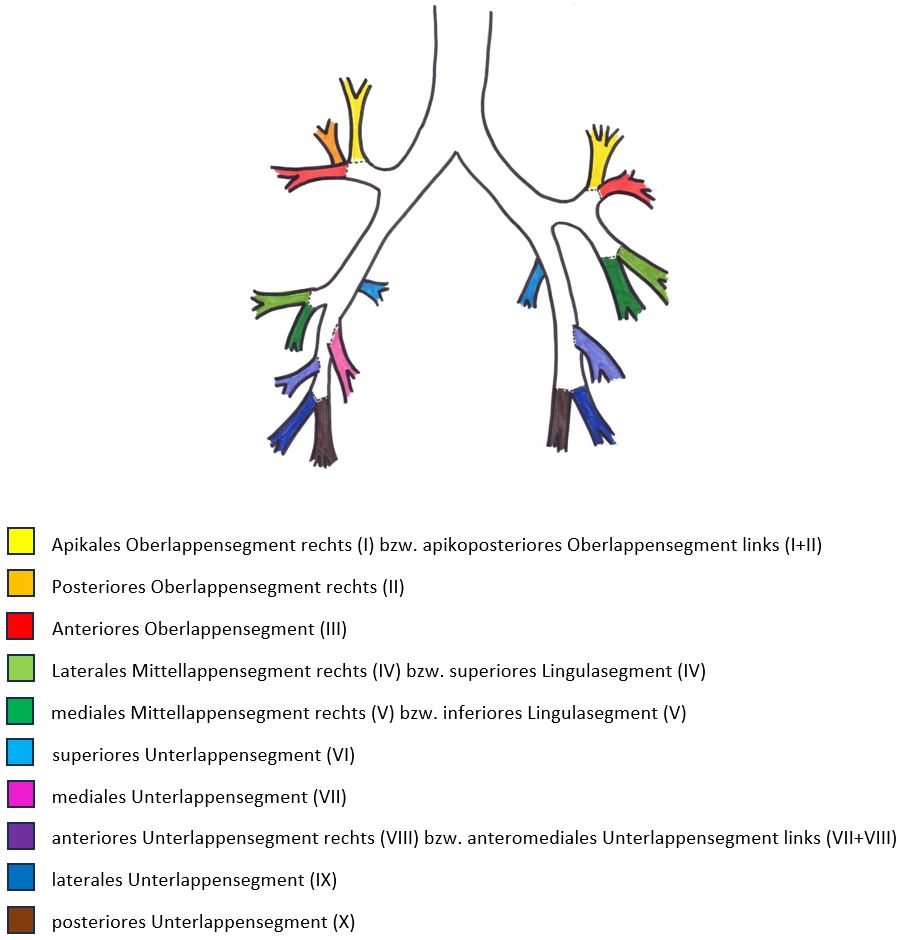
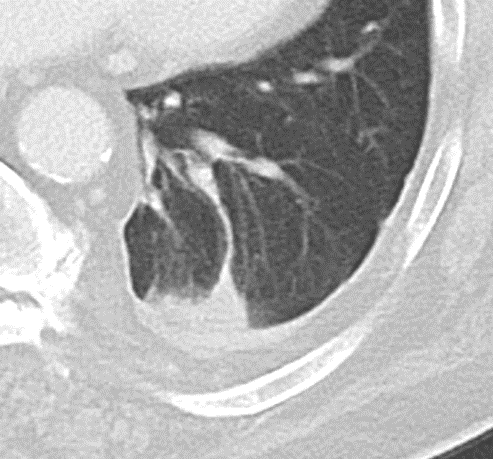
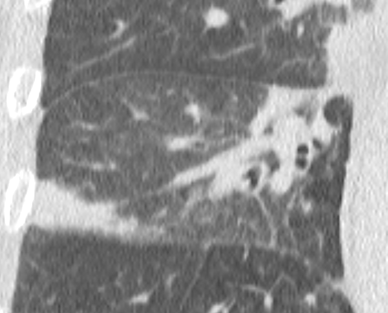
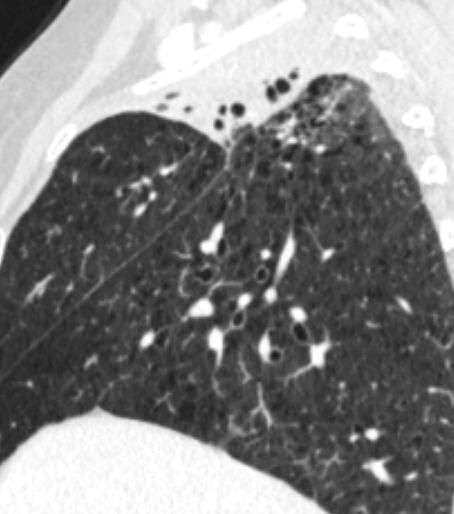
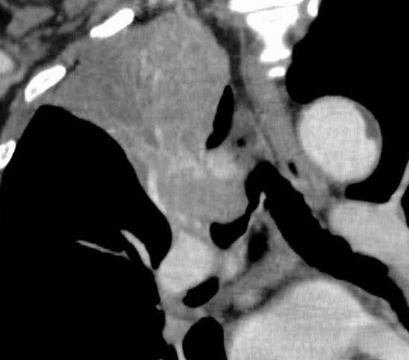
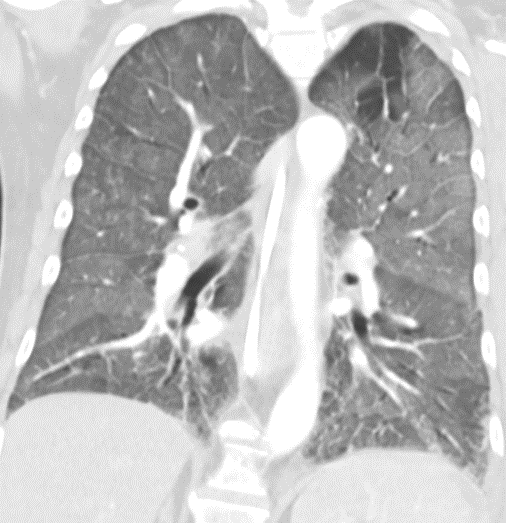
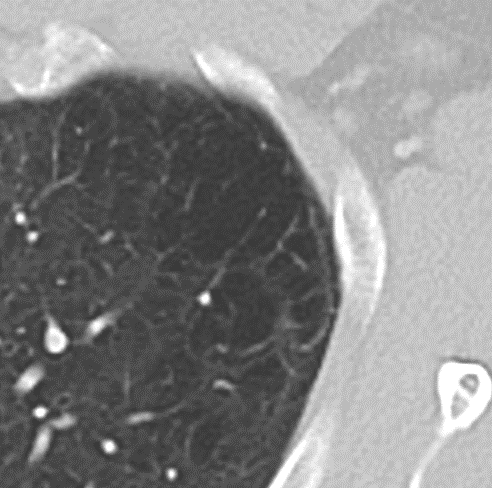
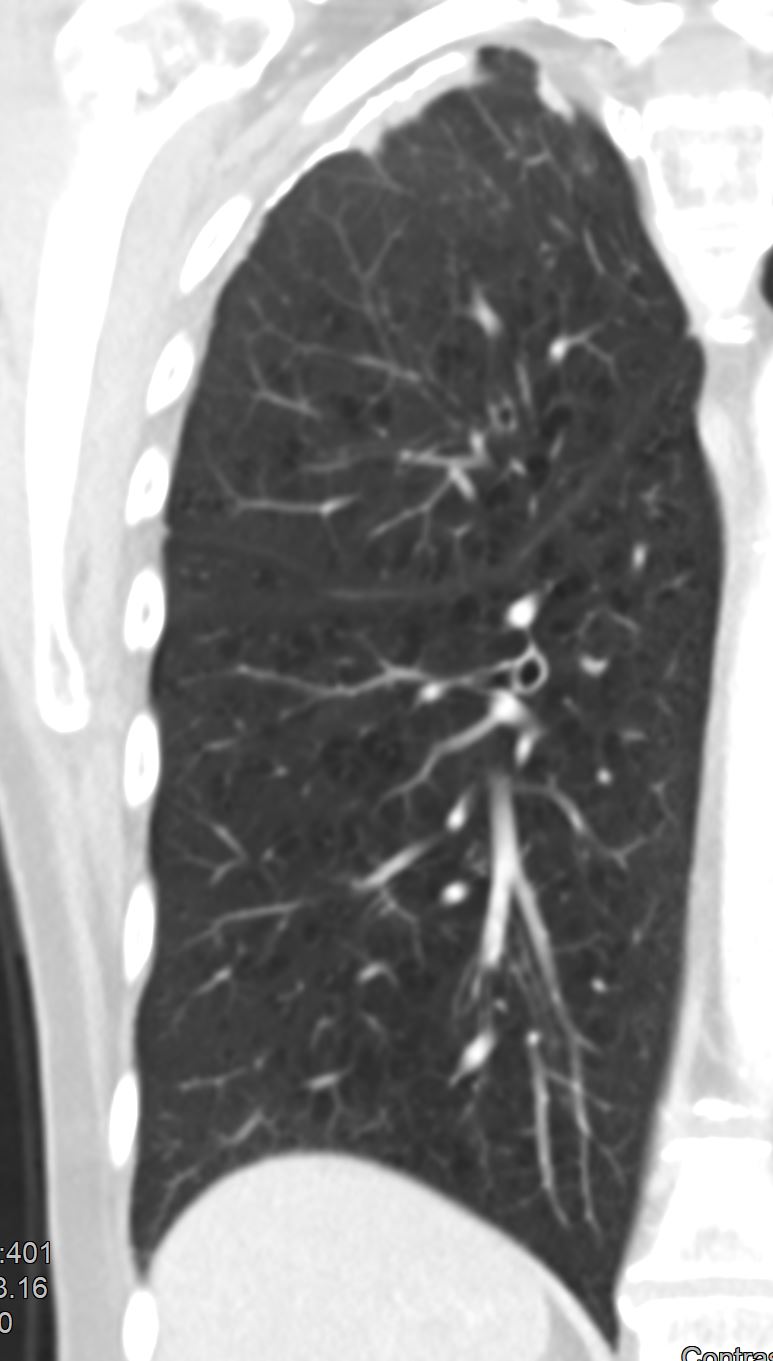
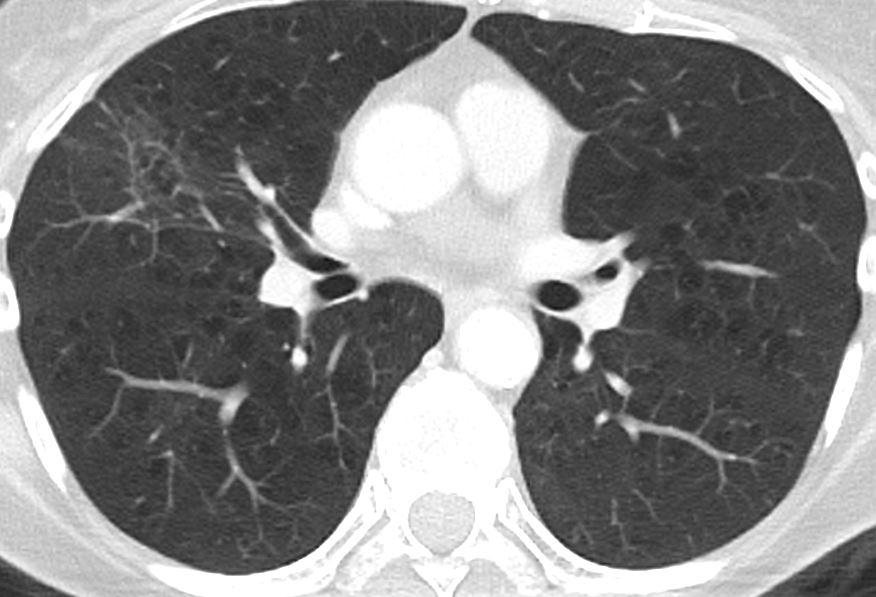
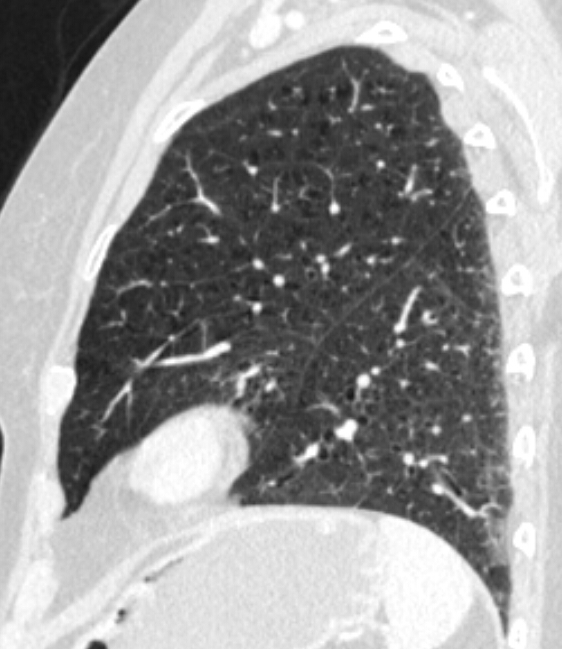
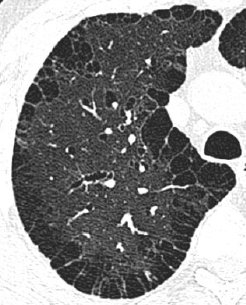
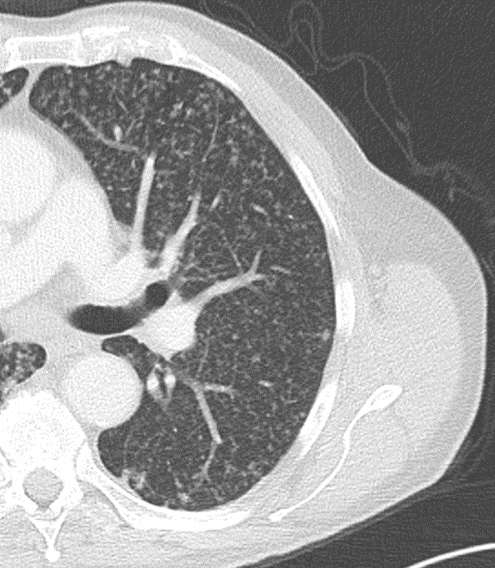
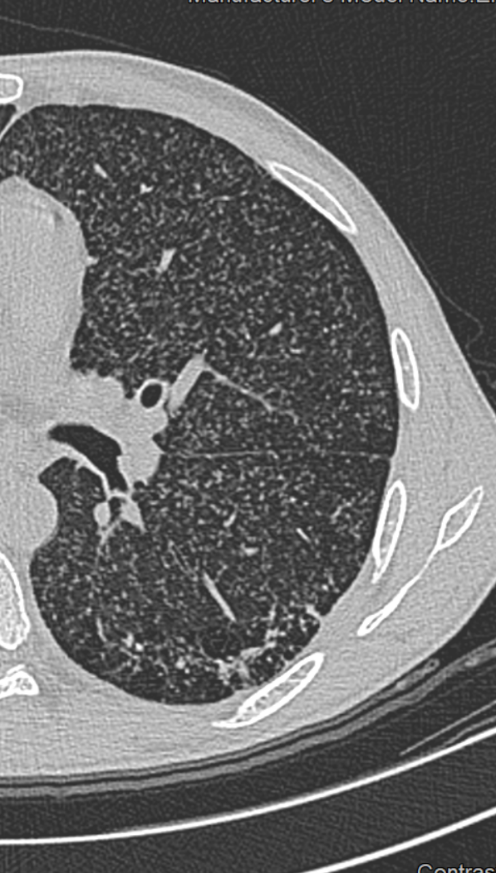
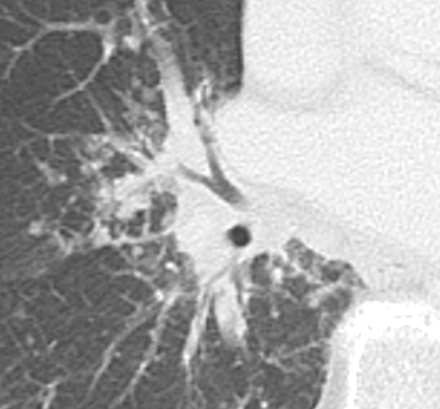
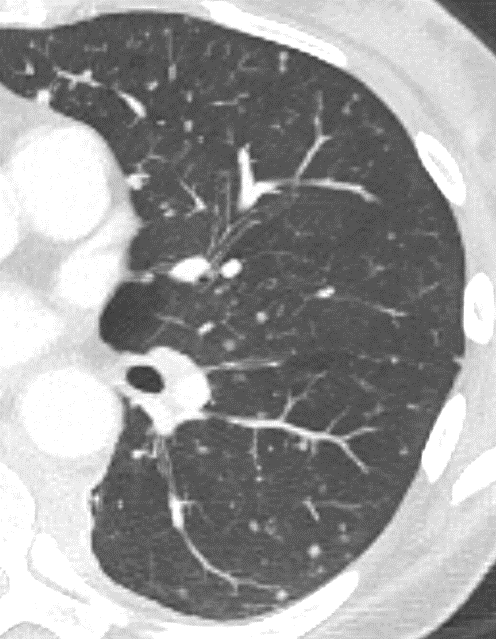
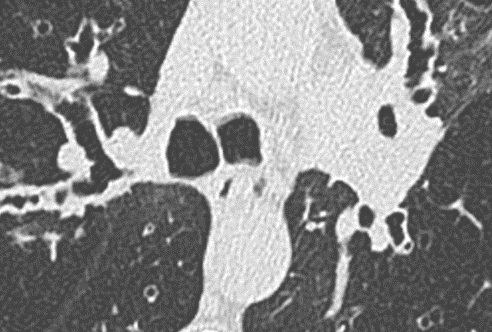
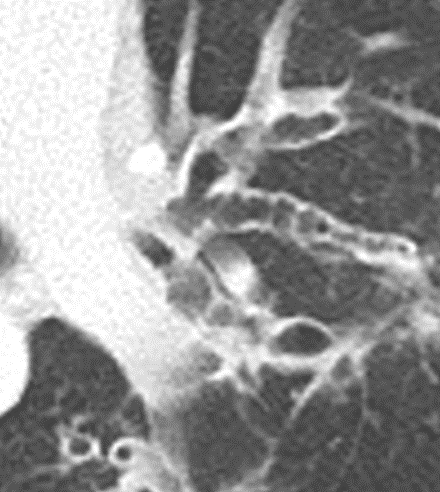
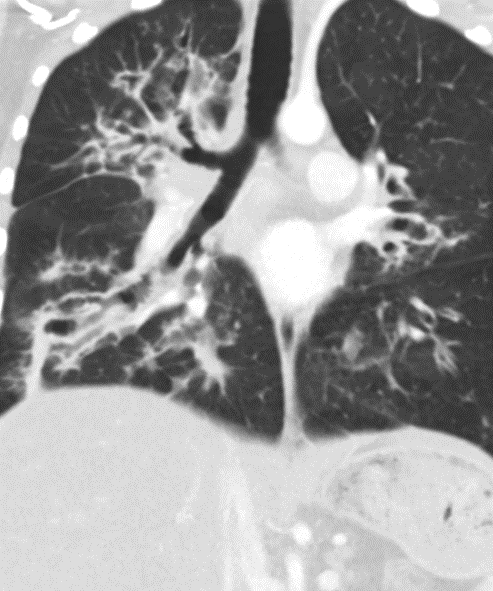
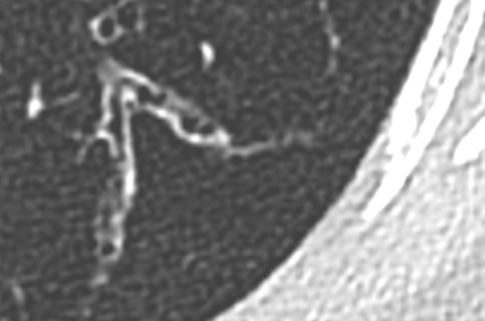
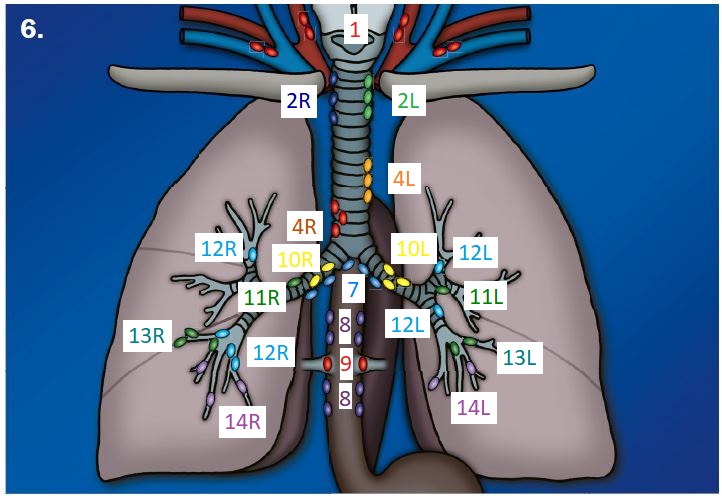
- Selbstverständlich müssen Sie die segmentale Anatomie der Lunge im CT-Schnitt kennen, damit Sie zu der hier beschriebenen Gradeinteilung anhand des Volumens eines Lungensegments in der Lage sind. Sollten Sie dort Unsicherheiten bei sich bemerken, bemühen Sie bitte Sekundärliteratur. Trösten Sie sich: Das ist radiologisches Basiswissen, auf das Sie, sobald einmal gelernt und verinnerlicht, während Ihrer gesamten Laufbahn zurückgreifen werden können. Als grundsätzliche Leitstruktur dient der Bronchialbaum auf Höhe der Segmentbronchien.
- Wie der Schweregrad bei den übrigen Pathologien (Emphysem, Herdbefunde, Bronchien, Pleura) eingeteilt wird, wird in den entsprechenden Kapiteln des Bildteils erläutert.
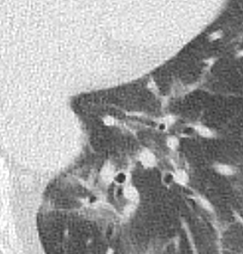
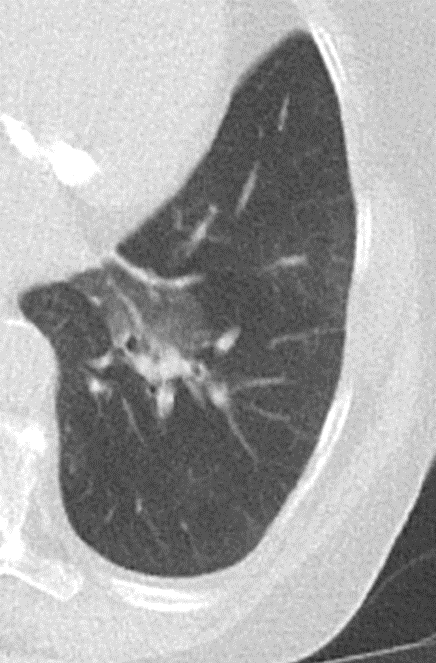
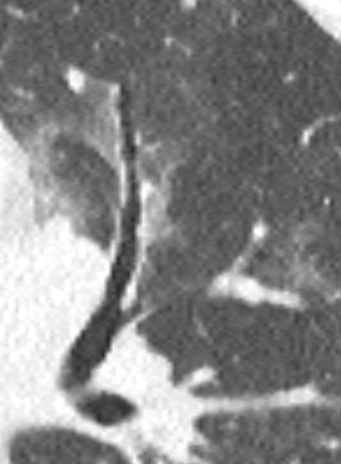
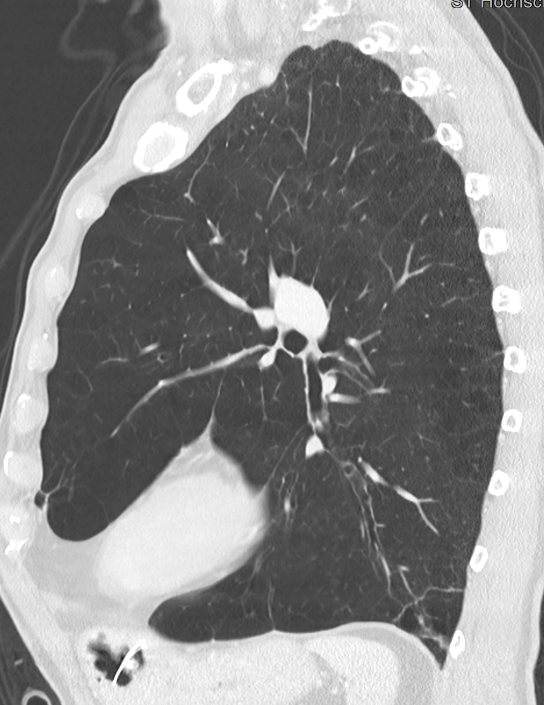
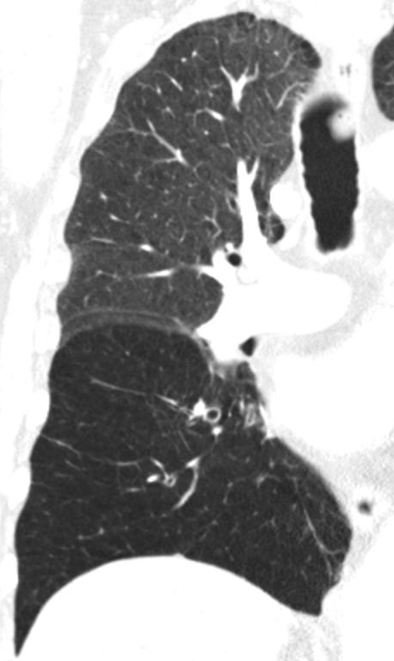
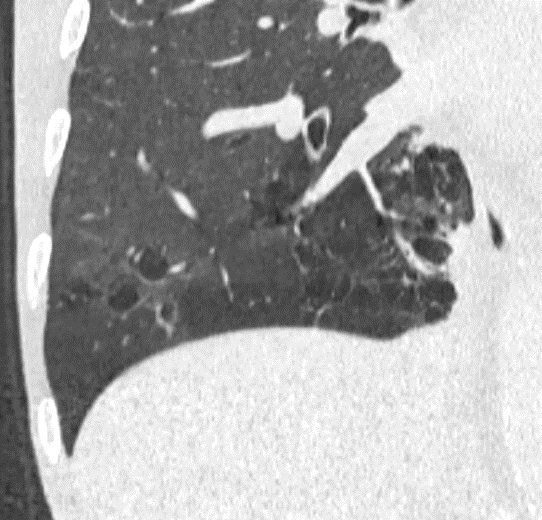
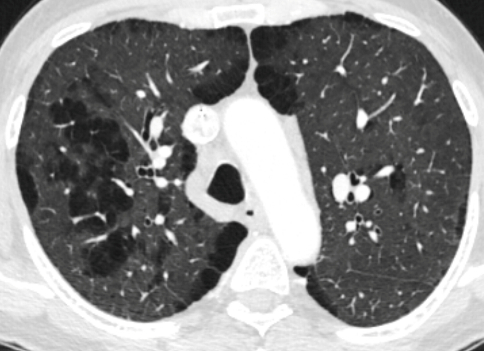
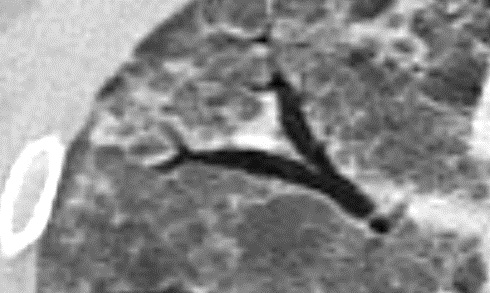
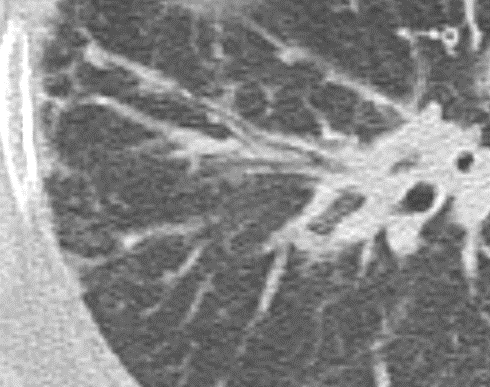
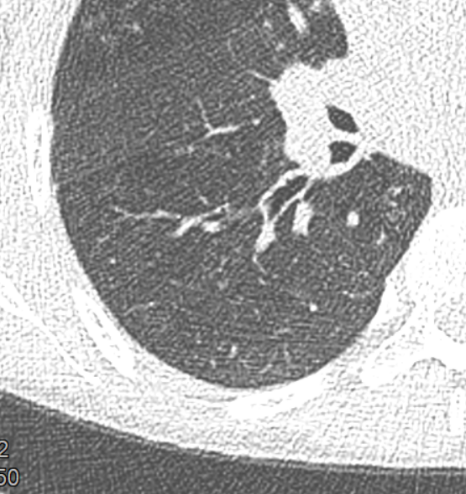
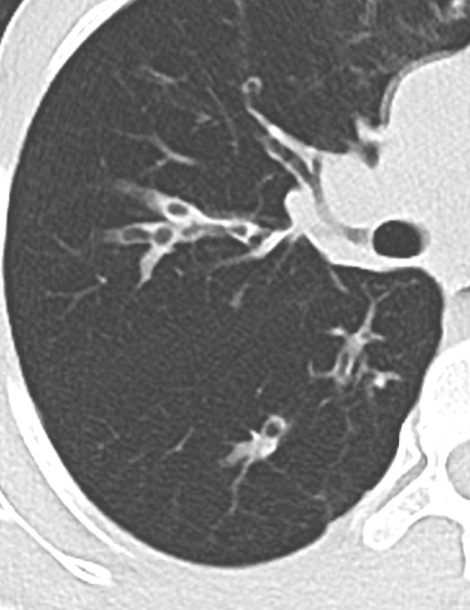
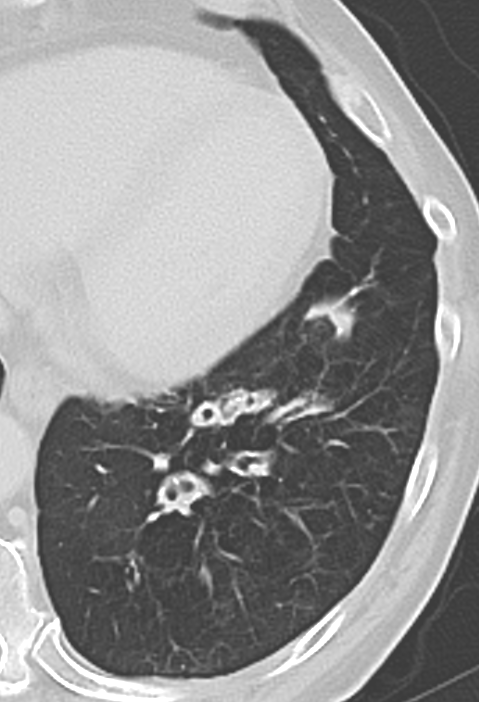
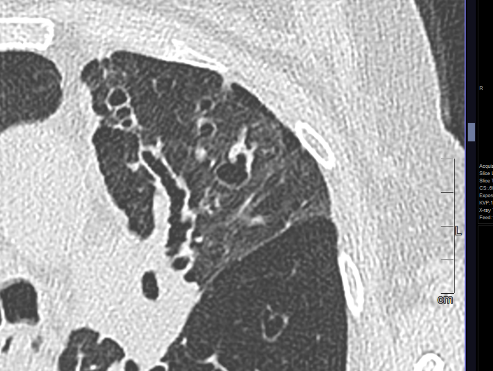
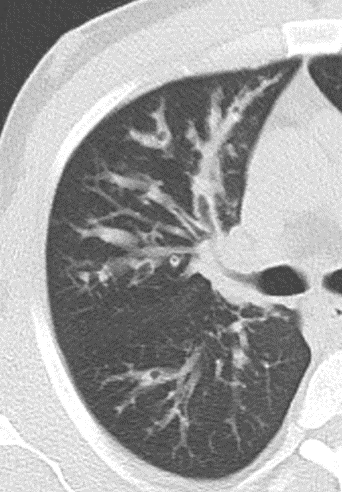
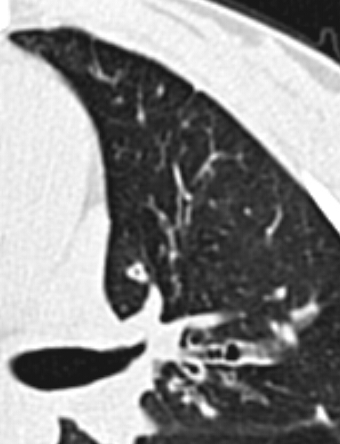
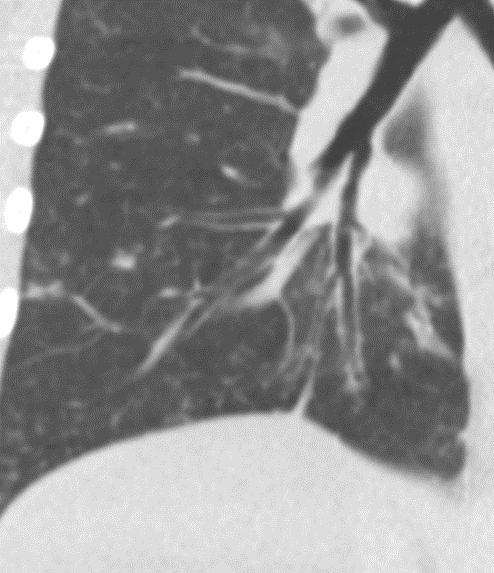
- Darstellung der Segmentbronchien in Farbe. Während des Segmentierungsprozesses werden diese Bronchien der Lunge zugeordnet, während die vorangehenden Bronchien mit dem Hilus verbunden sind.
- Die führende geographische Verteilung einer Pathologie wird hinsichtlich der gesamten Lunge und nicht pro Lappen beurteilt.
- Wenn nach der führenden geographischen Verteilung einer Pathologie gefragt ist, stehen üblicherweise die folgenden fünf Auswahlmöglichkeiten zur Verfügung:
- zentral
- peripher
- apikal
- basal
- kein Muster
- Es ist lediglich eine Einfachauswahl möglich, keine Kombinationen verschiedener führender Verteilungen. Wählen sie hier bitte stets das dominante Muster aus. Sollten einmal zwei oder mehr Verteilungsmuster absolut gleichberechtig vorkommen, ist “kein Muster” die beste Auswahl.
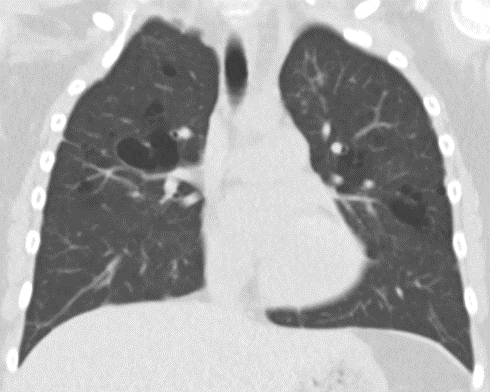
- Wenn eine Pathologie stark seitenasymmetrisch verteilt ist oder nur einen von beiden Lungenflügeln betrifft, soll die Verteilung auf der eindeutig schwerer betroffenen Seite beurteilt werden. Über die lappengetrennte Verteilung des Schweregrads lässt sich die Asymmetrie ja indirekt abbilden.
- Die führende anatomische Verteilung einer Pathologie wird hinsichtlich der gesamten Lunge und nicht pro Lappen beurteilt.
- Mit „anatomischer Verteilung“ meinen wir den differentialdiagnostisch häufig wegweisenden Bezug einer Pathologie zur anatomischen Architektur innerhalb der Lunge. Dass eine Pathologie z.B. gleichzeitig apikal und peribronchial lokalisiert sein kann, wird durch eine Aufteilung der führenden Verteilung in geographisch und anatomisch abgebildet.
- Um verschiedenen Pathologien möglichst gleichlautende Auswahlmöglichkeiten zuweisen zu können war es unumgänglich, das Glossar der Fleischner Society für RACOON behutsam zu vereinfachen. Wir hoffen, dass wir einen vernünftigen Mittelweg aus Praktikabilität und inhaltlicher Exaktheit gefunden haben.
- Bei flächigen Pathologien wie Konsolidierung und Milchglasareal stehen u.a. folgende Auswahlmöglichkeiten zur Verfügung:
- peribronchial
- paraseptal
- landkartenartig
- kein Muster
- „Peribronchial“ bedeutet peribronchovaskulär, also eine eindeutige Assoziation des Befunds mit den pulmonalen Leitungsbahnen und dem begleitenden zentralen Interstitium. Möglicherweise kann eine radiäre Ausbreitung vom Hilus in die Peripherie beobachtet werden.
- „Paraseptal“ bedeutet eine dominante Ausbreitung entlang bindegewebiger Septen in der Lunge, also sowohl subpleural entlang der Pleura visceralis inklusive der Lappenspalten, als auch entlang der interlobulären Septen (s.u.). Synonym wird häufig auch der Begriff “perilymphatisch” verwendet.
- „Landkartenartig“ ist gerade hinsichtlich der typischen Veränderungen durch COVID-19 unverzichtbar. Gemeint ist eine scharfe, eben landkartenartige Abgrenzbarkeit zwischen normalem Lungengewebe und Arealen mit pathologischer Dichteabweichung. Diese kann in beide Richtungen stattfinden, z.B. Dichteerhöhung durch alveoläre Flüssigkeitseinlagerungen in Konsolidierung / Milchglasareal oder Dichteabsenkung durch Überblähung im Rahmen eines regional betonten Emphysems oder eines sog. Air-trappings als Folge einer Bronchusobstruktion.
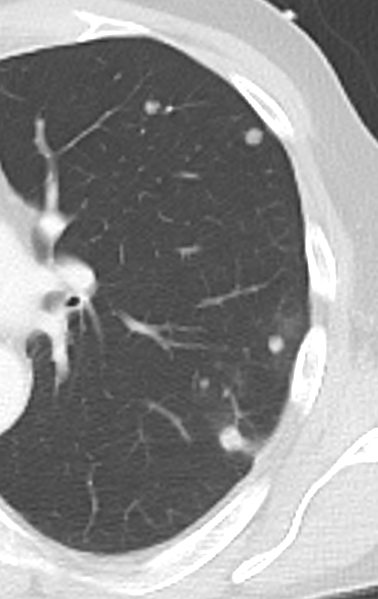
- Bei den interstitiellen und herdbildenden Pathologien Retikulationen, Rundherd*/Knoten* und Nodulus* < 5 mm stehen u.a. folgende Auswahlmöglichkeiten zur Verfügung:
- perilymphatisch
- zentrilobulär
- intralobulär
- random
* Rundherd, Knoten und Nodulus sind synonyme Begriffe. Um schnell optisch zwischen den Themengebieten unterscheiden zu können, wird im RACOON Atlas der Begriff ‘Nodulus’ für kleine Läsionen < 5 mm genutzt, ‘Rundherd/Knoten’ für größere Läsionen von 5-30mm.
- Diese Ortsangaben beziehen sich auf die Verteilung einer Pathologie innerhalb des sekundären pulmonalen Lobulus (SPL). Die Kenntnis des SPL ist unverzichtbar, um eine führende anatomische Verteilung korrekt zu erkennen.
- Der SPL ist eine polygonale Struktur von ca. 10-25 mm Durchmesser und die kleinste anatomische Struktureinheit des Lungenparenchyms, die von Bindegewebe umgeben ist. Normalerweise kann man einen einzelnen SPL im CT-Bild nicht von seiner Umgebung abgrenzen, dafür sind seine anatomischen Grenzen einfach zu dünn, liegen unter der Auflösungsschwelle auch modernster Computertomographen.
- In der bindegewebigen Hülle eines SPL verlaufen die Venolen und Lymphgefäße. Die sog. interlobulären Septen werden als retikuläre Zeichnungsvermehrung sichtbar, wenn diese Gefäße oder das umgebende interstitielle Bindegewebe vermehrt Flüssigkeit enthalten. Sicherlich haben Sie schon einmal ein CT-Bild mit wabenartiger Zeichnungsvermehrung der interlobulären Septen bei einem Patienten mit Herzinsuffizienz und pulmonalvenöser Stauung gesehen.
- Die Luft- und Blutzufuhr eines SPL erfolgt durch die zentrilobulären Strukturen; d.h. eine distale (sozusagen „präterminale“) Bronchiole mit ihrer begleitenden Arteriole. Kommt es zu einer Dichteanhebung dieser Strukturen, z.B. durch Wandverdickung, Ektasie der Arteriole oder Verstopfung des Bronchiolus, werden im CT-Bild zentrilobuläre „Knötchen“ sichtbar.
- Innerhalb eines SPL befinden sich ca. 5-25 Azini. Diese sind nicht bindegewebig umkapselt und zu klein, als dass sie im CT-Bild einzeln sichtbar werden können. Bei patholgischer Verdickung, wie z.B. bei fibrosierenden Erkrankungen, kann jedoch auch dieses intralobuläre Interstitium in Form intralobulärer Septen sichtbar werden. Jeder Azinus wird von einem eigenen Bronchiolus terminalis versorgt. Dahinter kommen nur noch respiratorische Bronchiolen, die, wie der Name schon sagt, selber schon am Gasaustausch teilnehmen.
- „Perilymphatisch“ bedeutet eine dominante Verteilung entlang der Lymphgefäße; also peribronchovaskulär, interlobulär und entlang der Pleura.
- „Zentrilobulär“ bedeutet die dominante Lokalisation einer Pathologie im Zentrum der SPL, was, wie oben beschrieben, meist durch Verdickung oder Verstopfung des zentrilobulären Bronchiolus bzw. seiner begleitenden Arteriole verursacht wird. Zentrilobulär lokalisiert können dann solide und nicht-solide Noduli und Mikronoduli gesehen werden. Zentrilobulär ist ebenfalls die korrekte Auswahl für ein initiales Lungenemphysem und wird dort für den Schweregrad verwendet (Kapitel 4).
- Das „Tree-in-bud-Zeichen“ (auf Deutsch etwa „Baumknospenzeichen“) bedeutet, dass normalerweise unsichtbare Bronchiolen im CT-Bild sichtbar werden. Dies ist die Folge bronchiolärer Wandverdickung und/oder Lumenobstruktion und kann z.B. durch Bronchiolitis, Mikroaspiration oder endoluminales Tumorwachstum verursacht sein.
- „Intralobulär“ bezeichnet sichtbare (fibrotische) Retikulationen innerhalb eines SPL, also eine feinere Netzzeichnung, als durch verdickte interlobuläre Septen hervorgerufen.
- „Random“ bedeutet ein zufälliges Verteilungsmuster von nodulären Herdbefunden wie Granulomen oder Metastasen und von fibrotisch-retikulären Veränderungen, das sich eben nicht am anatomischen Aufbau der Lunge orientiert.
- Es ist lediglich eine Einfachauswahl möglich, keine Kombinationen verschiedener führender Verteilungen. Sollten einmal zwei oder mehr Verteilungsmuster absolut gleichberechtig vorkommen, ist “random” die korrekte Auswahl.
- Wenn eine Pathologie stark asymmetrisch verteilt ist oder nur einen von beiden Lungenflügeln betrifft, soll die Verteilung auf der eindeutig schwerer betroffenen Seite beurteilt werden.
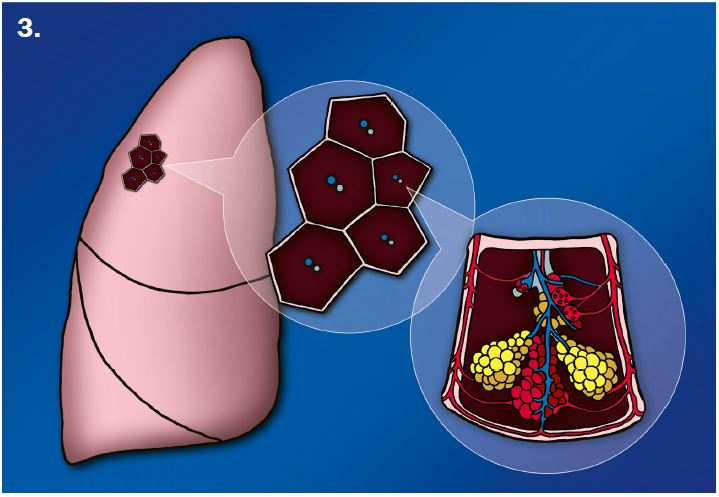
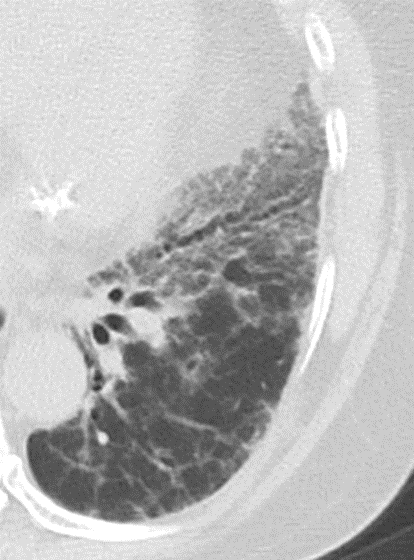
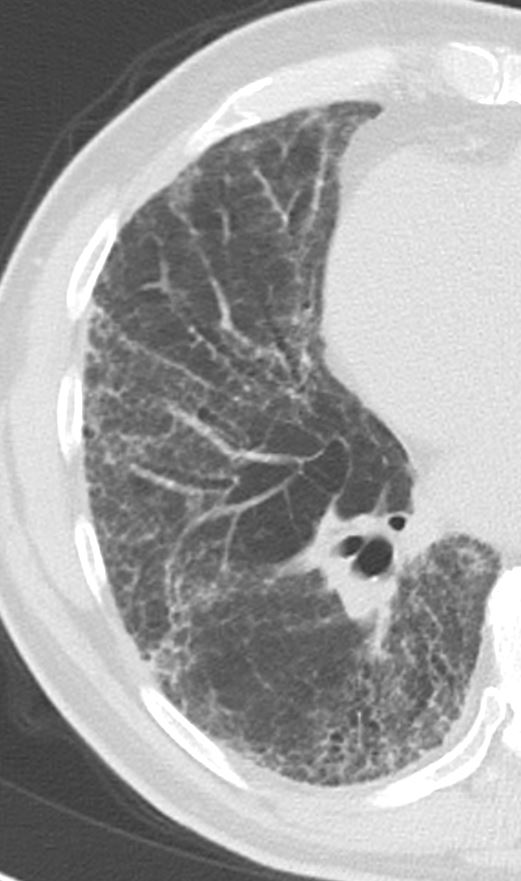
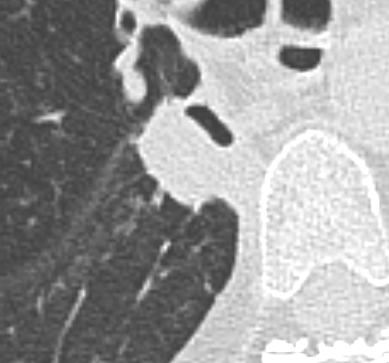
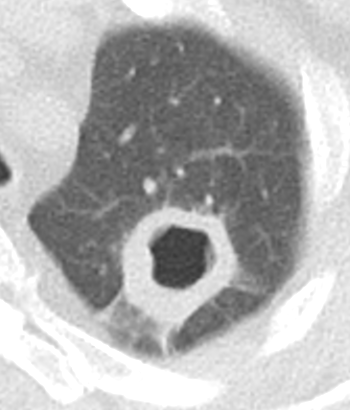
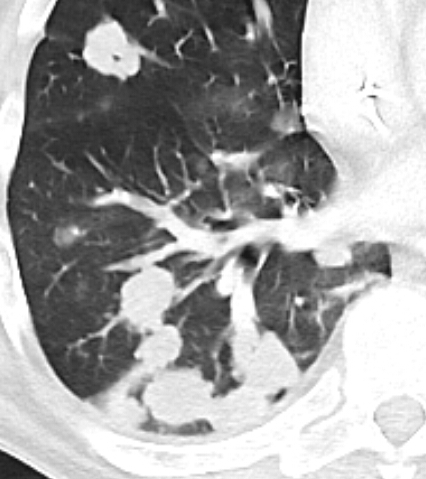
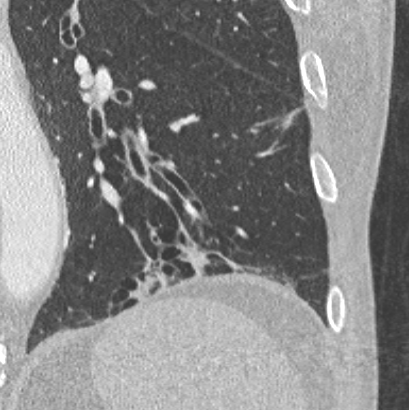
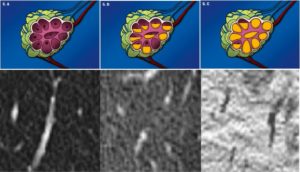
Der sekundäre pulmonale Lobulus:
Die Arteriole (blau) zieht mit ihrem Bronchiolus (hellblau) in den SPL und führt das sauerstoffarme Blut. Im Kapillarnetz der Alveolen wird das Blut oxigeniert und dann durch die Venolen (rot) den Lungenvenen zugeführt. Die Venolen liegen mit den hier nicht dargestellten Lymphgefäßen in den interlobulären Septen des SPL.
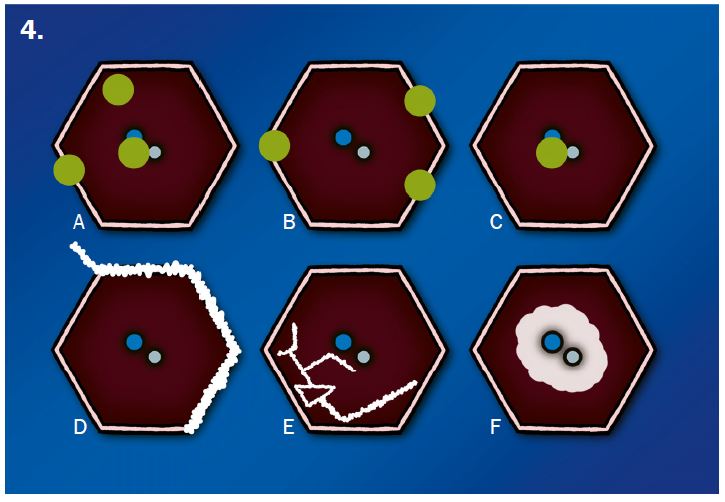
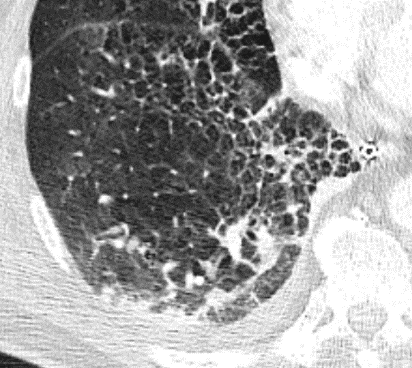
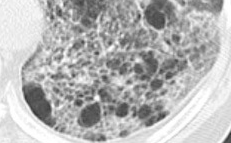
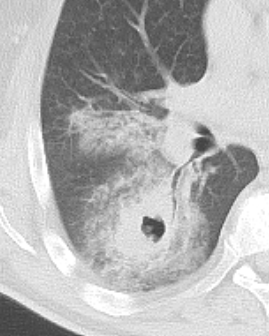
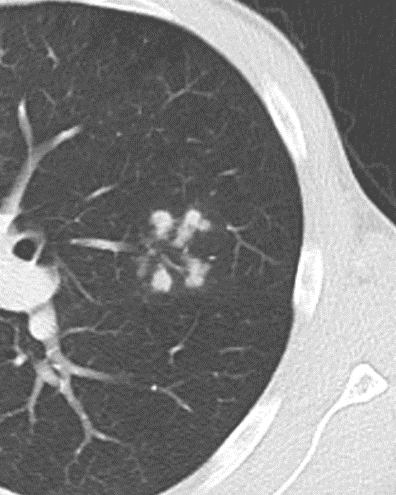
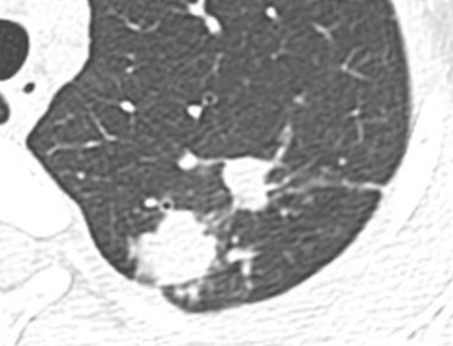
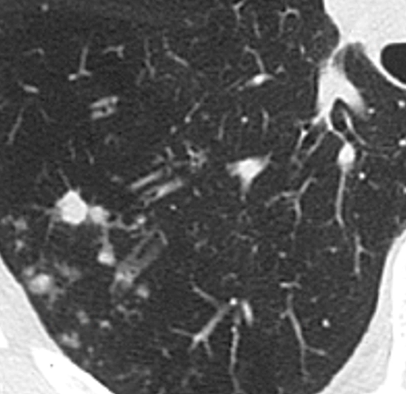
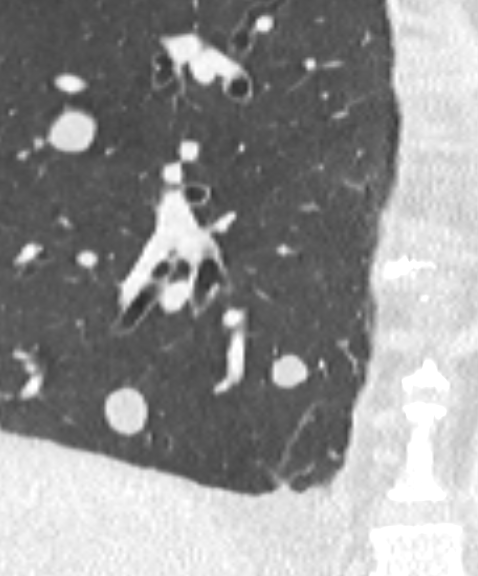
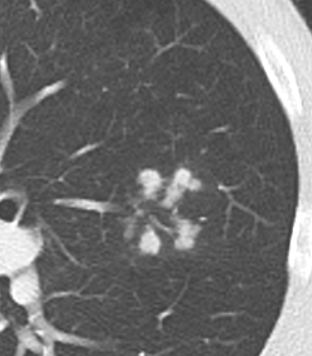
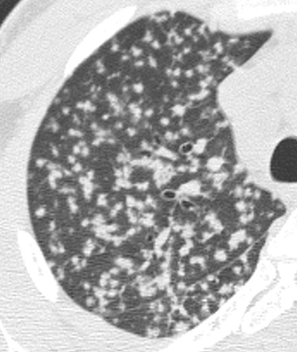
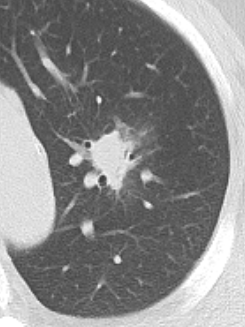
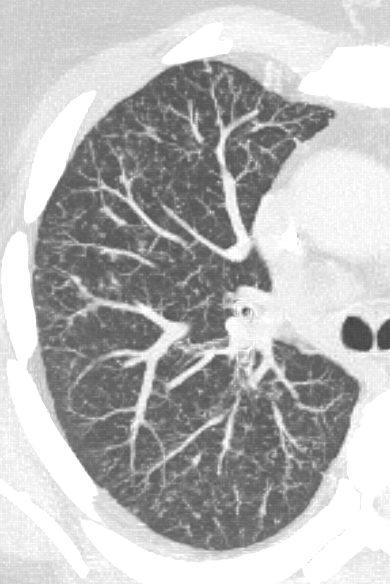
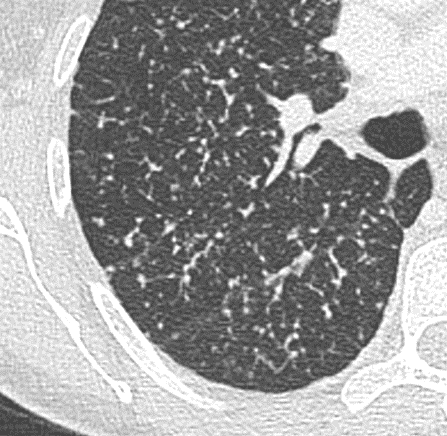
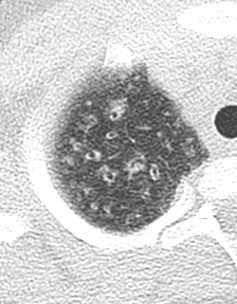
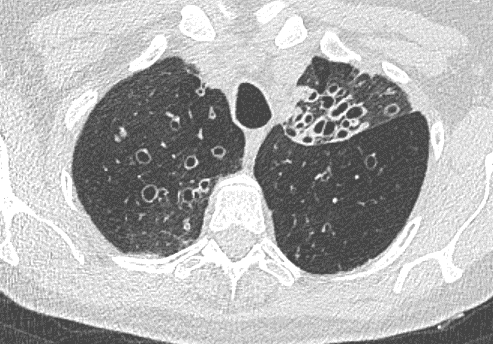
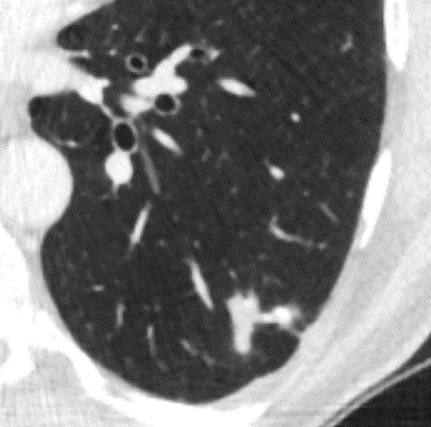
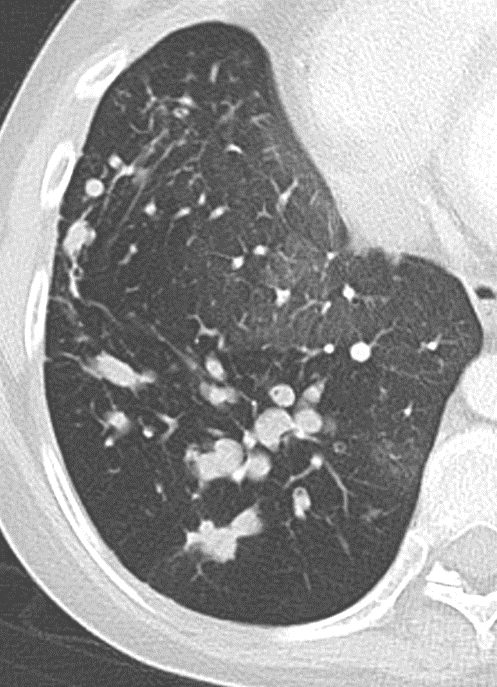
Verteilungsmuster nodulärer Herdbefunde:
A) Random (= zufallsverteilte) Noduli; z.B. hämatogene Metastasen oder miliare TBC
B) Perilymphatische Noduli; z.B. Sarkoidose oder Lymphangiosis carcinomatosa
C) Zentrilobuläre Noduli; z.B. endobronchiale Streuung
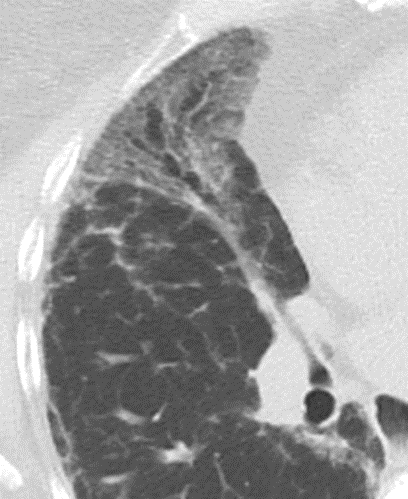
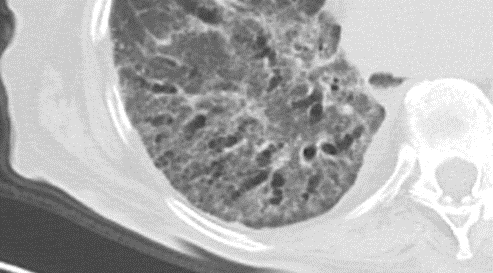
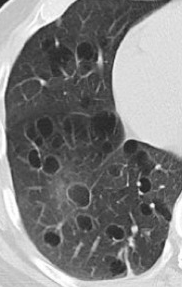
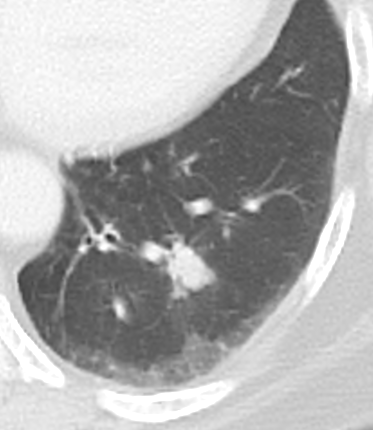
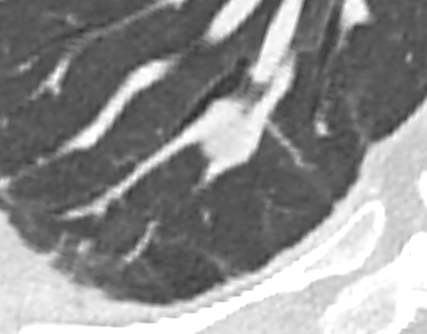
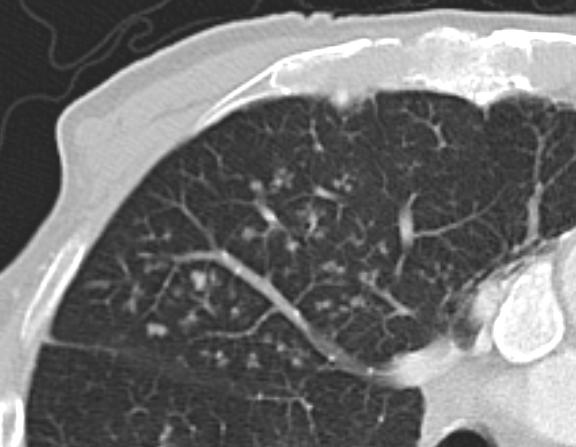
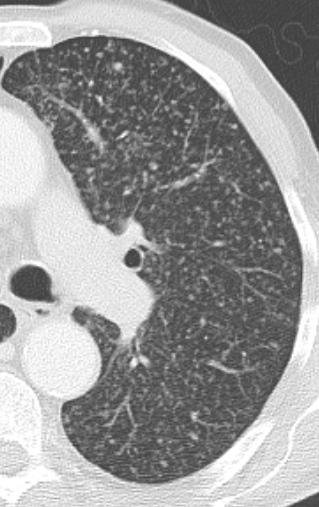
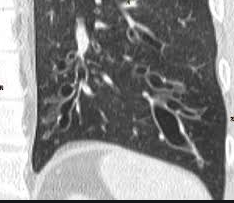
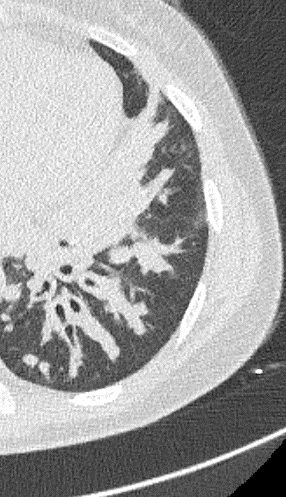
Verteilungsmuster von Retikulationen:
D) Interlobuläre/Perilymphatische* Retikulationen; z.B. interstitielles Lungenödem
E) Intralobuläre Retikulationen; z.B. Lungenfibrose
F) Schema zentrilobulärer Verteilung am Beispiel Emphysem
* Perilymphatische und interlobuläre Retikulation sind in RACOON Synonym zu gebrauchen. Der Begriff ‘Perilymphatisch’ wurde ausgewählt, um Verwechselungen zu verhindern.
| Kapitel | Pathologie | Schweregrad | Lokalisation nach Lungenlappen | Lokalisation nach Seite | Führende Verteilung geographisch | Führende Verteilung anatomisch | Zusatz |
| 1 | Atelektase / Narbe |
✓ |
✓ | ✓ |
✓ |
||
| 2 | Konsolidierung |
✓ |
✓ | ✓ | ✓ |
✓ |
|
| 3 | Milchglasareal |
✓ |
✓ | ✓ | ✓ |
✓ |
|
| 4 | Emphysem |
✓ |
✓ | ✓ |
✓ |
||
| 5 | Retikulation |
✓ |
✓ | ✓ | ✓ |
✓ |
|
| 6 | Kavitation |
✓ |
✓ |
✓ |
|||
| 7 | Raumforderung |
✓ |
✓ |
✓ |
|||
| 8 | Knoten / Knötchen |
✓ |
✓ | ✓ | ✓ |
✓ |
|
| 9 | Mikronoduli | ✓ | ✓ | ✓ | ✓ |
✓ |
|
| 10 | Wandverdickungen |
✓ |
✓ | ✓ |
|
||
| 11 | Bronchiektasen | ✓ | ✓ | ✓ |
|
✓ | |
| 12 | Pneumothorax |
✓ |
✓ | ||||
| 13 | Pleuraerguss |
✓ |
✓ |
✓ |
|||
| 14 | Pleuraerkrankung |
✓ |
✓ | ✓ |
✓ |
||
| 15 | Arterienverschluss |
✓ |
✓ | ✓ |
✓ |
||
| 16 | Tr. pulmonalis |
✓ |
|||||
| 17 | Lymphknoten / Tumor | ✓ | ✓ |
✓ |
Die markierten Felder werden im Rahmen der strukturierten Befundung mit der MintLesion-Software abgefragt und müssen zwingend beantwortet werden.
II. Praxis
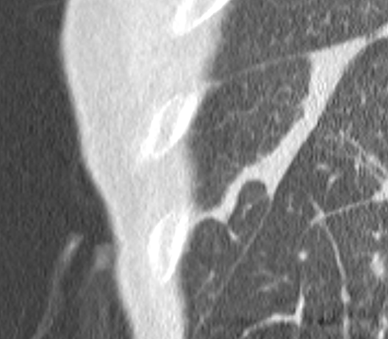
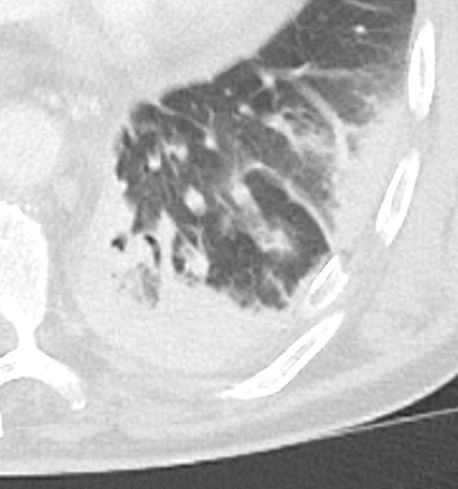
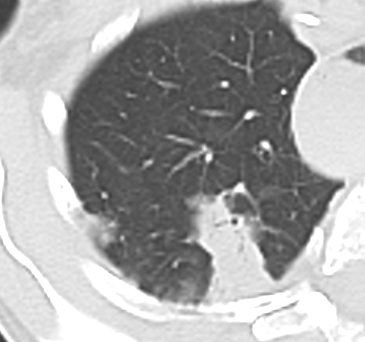
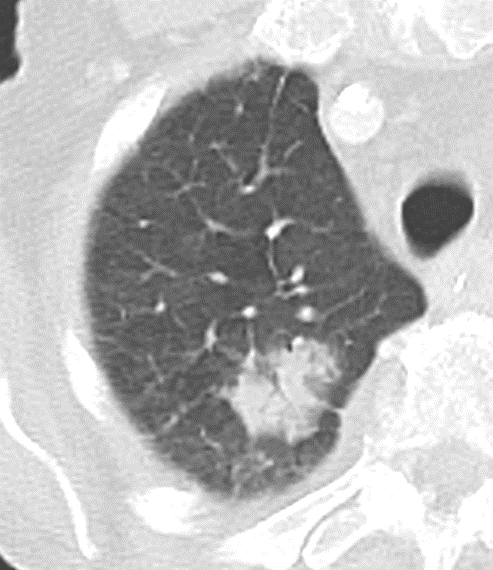
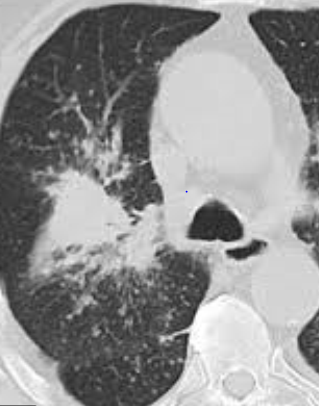
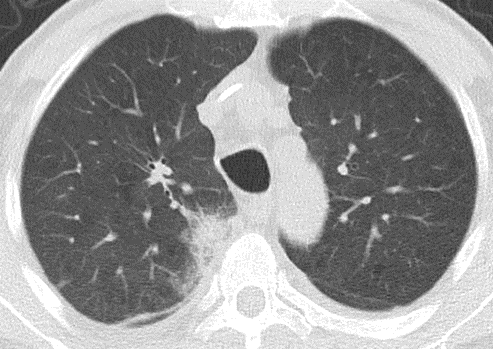
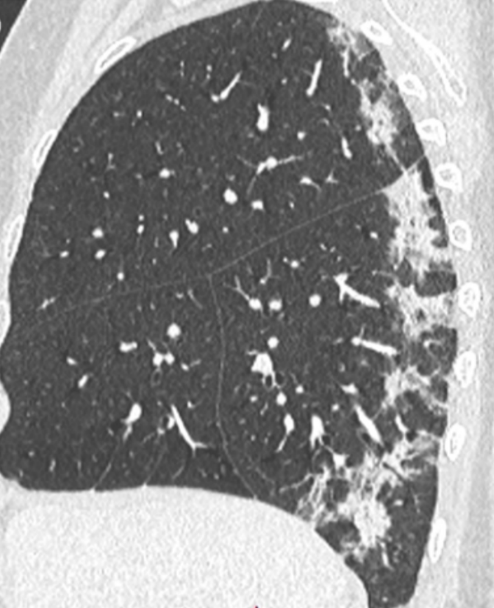
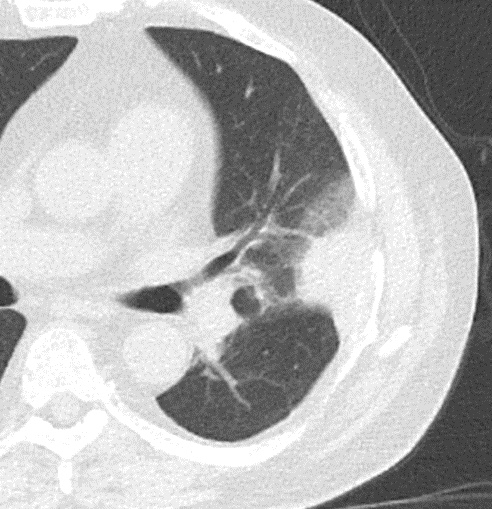
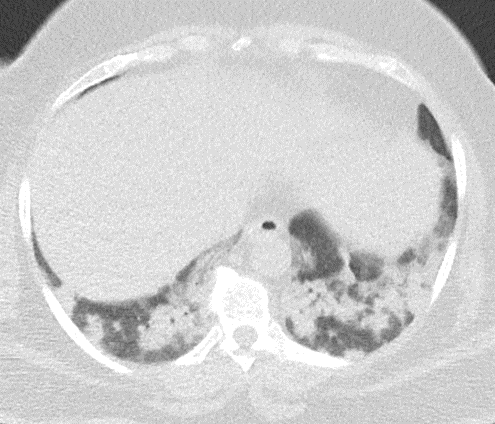
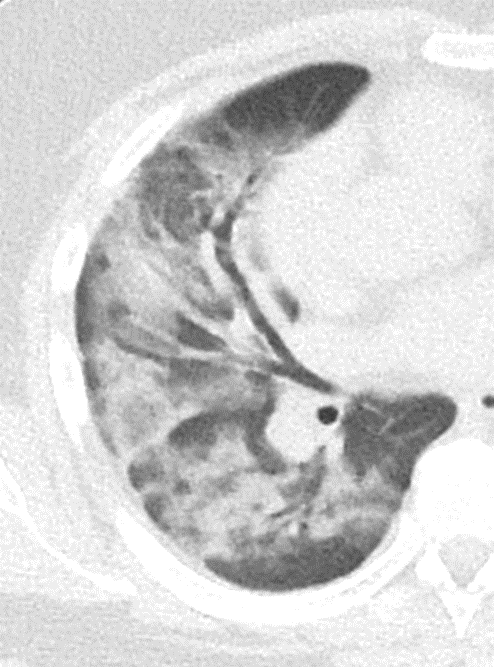
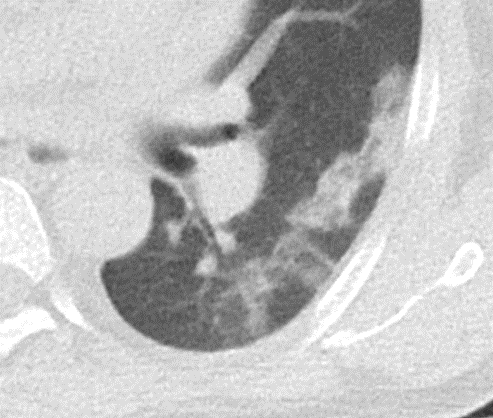
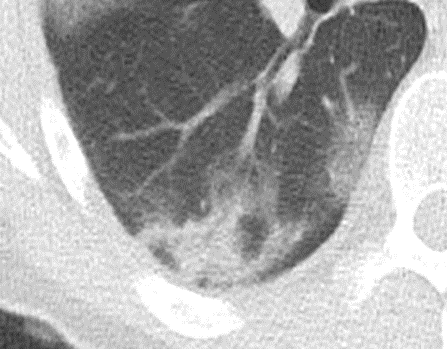
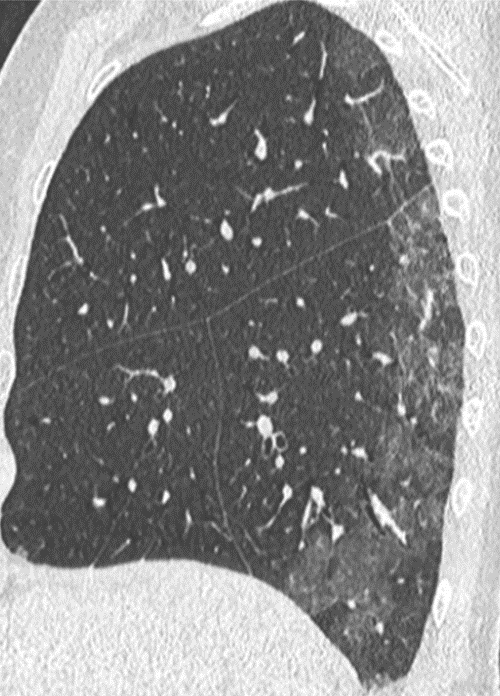
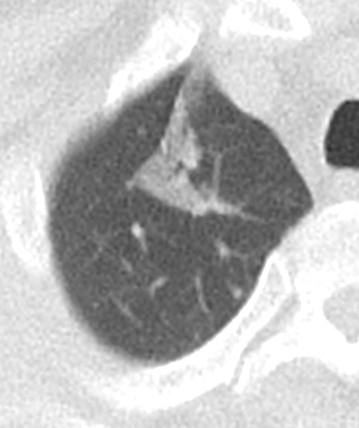
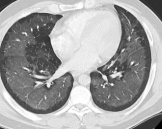
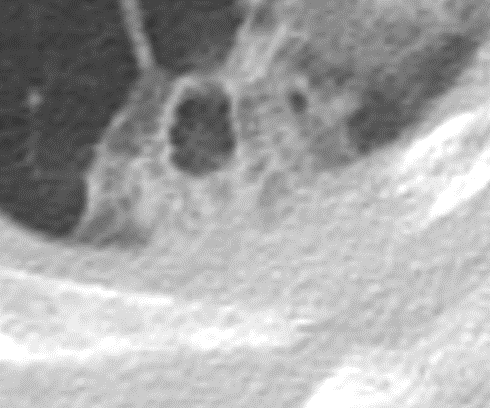
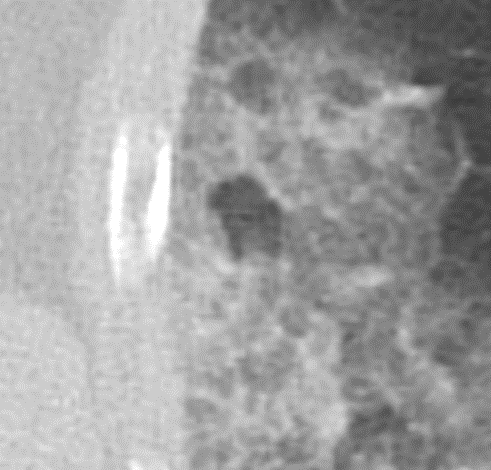
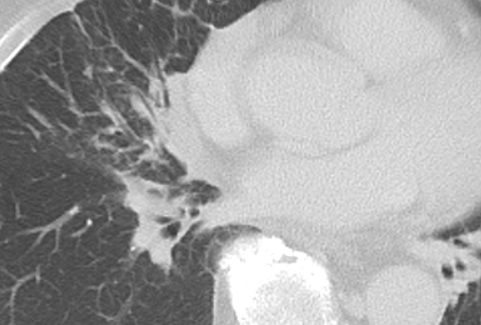
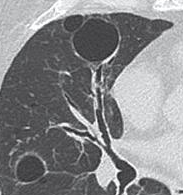
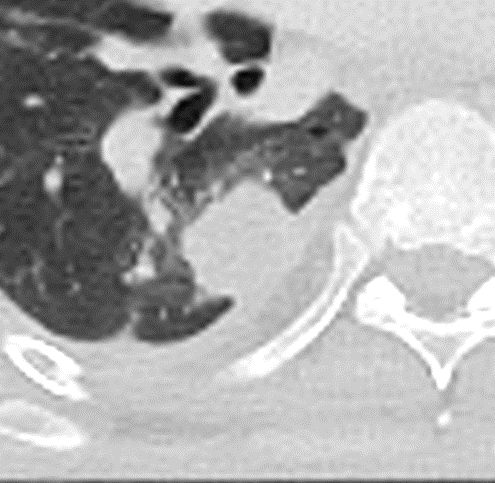
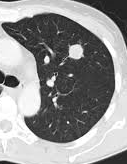
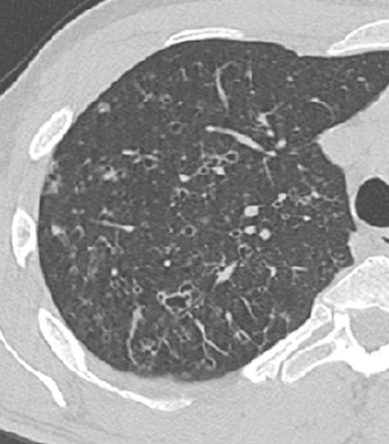
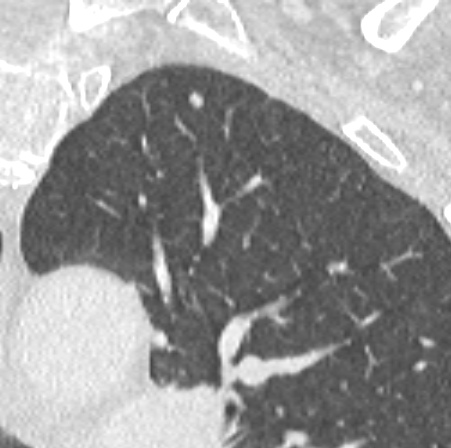
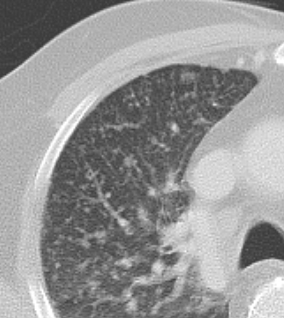
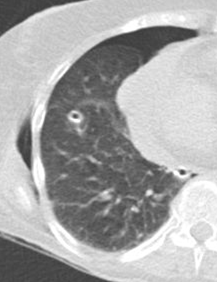
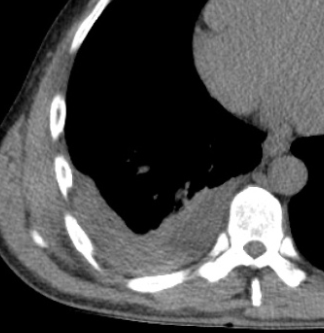
Atelektase/Narbenstrang
Definition/ Schweregrad:
- Eine Volumenminderung erzeugende Entlüftung des betroffenen Lungenparenchyms durch z.B. Kompression (Pneumothorax, Pleuraerguss), vorgeschalteten Bronchusverschluss (Aspirat, Fremdkörper, Tumor) oder narbige Verklebung.
- Atelektatisches/narbiges Lungenparenchym soll relativ homogen dichteangehoben sein und der Abstand der darin evtl. noch abgrenzbaren Bronchien soll durch die Volumenminderung reduziert sein.
DDx:
- Die Atelektase/Narbe sollte im Gegensatz zur Konsolidierung relativ scharf berandet sein und in den meisten Fällen bis auf die Pleura reichen.
- Eine Sonderform ist die Kugel- oder Rundatelektase, die leicht mit einer Raumforderung bzw. einem Knoten verwechselt werden kann. Charakteristisch hierbei ist jedoch auch der zuführende Bronchus, der bei dieser Sonderform nicht gerade in die Atelektase hinein, sondern gebogen um sie herumläuft.
Zusatz:
- Radiäre und kurvilineare Verdichtungen entsprechen inhaltlich meistens kleinen Plattenatelektasen oder Narbensträngen, sind häufig in Normalbefunden vorhanden und können mehrere Zentimeter lang werden. Veränderungen dieser Art sollten nur als Pathologie dokumentiert werden, wenn sie über das gewöhnliche Maß hinaus verdickt sind und einen Großteil des Lappens umfassen.
- Gerade chronische Atelektasen können makroskopische Verkalkungen aufweisen. Seriös lässt sich das nur in nativen CT-Untersuchungen beurteilen.
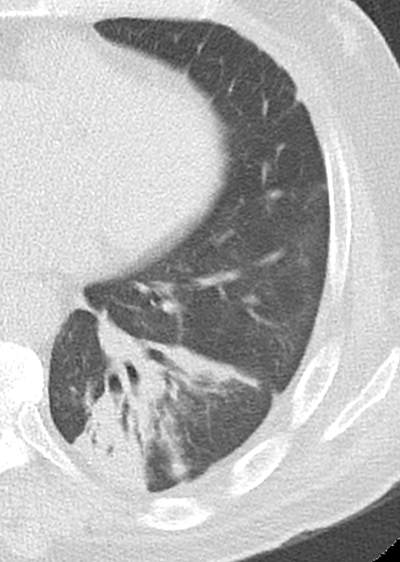
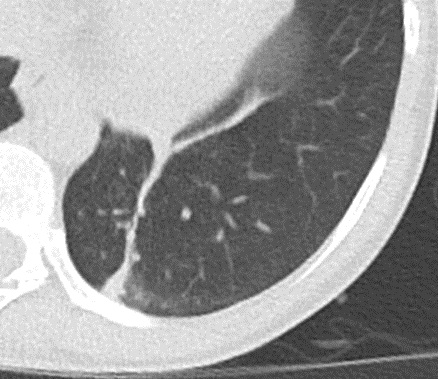
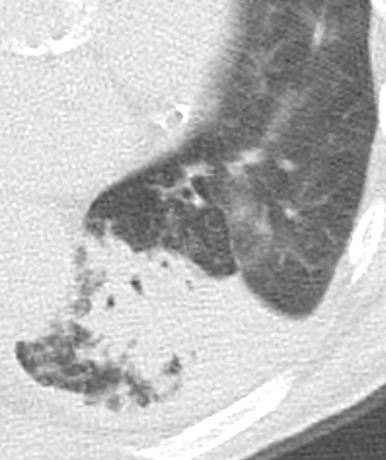
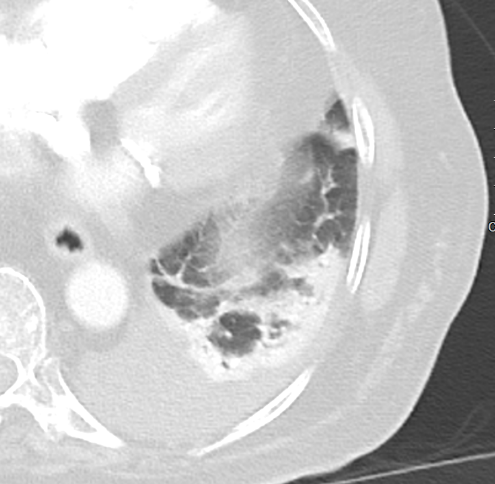
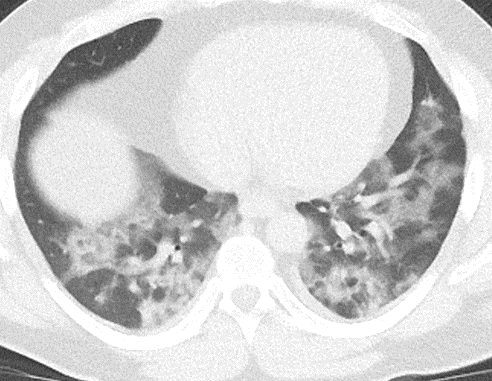
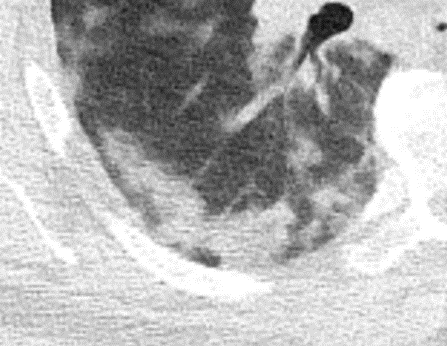
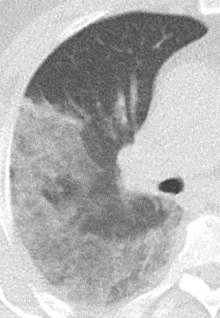
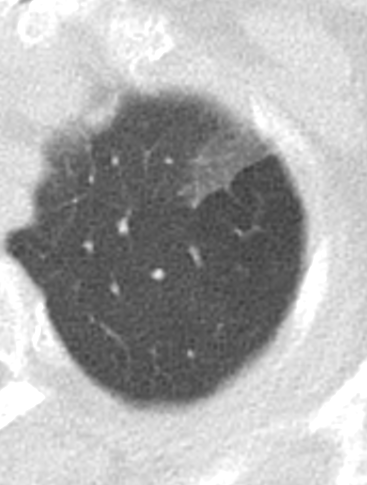
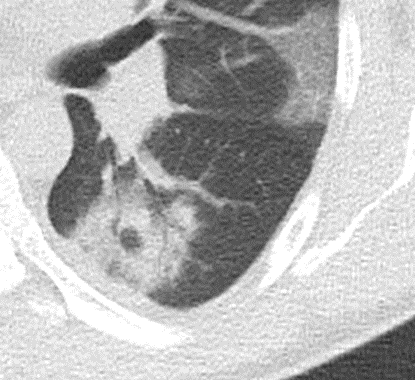
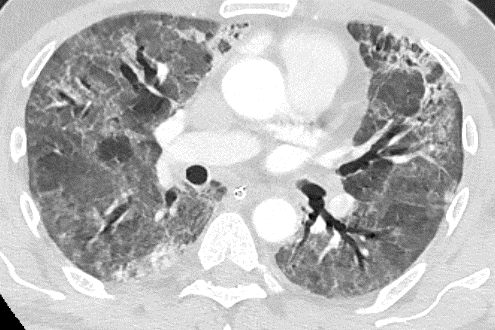
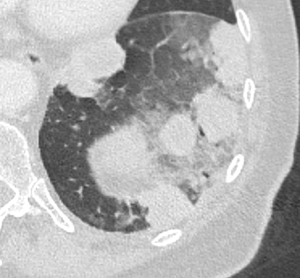
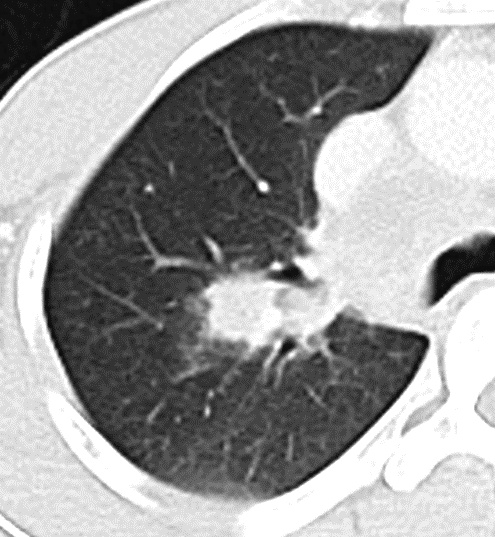
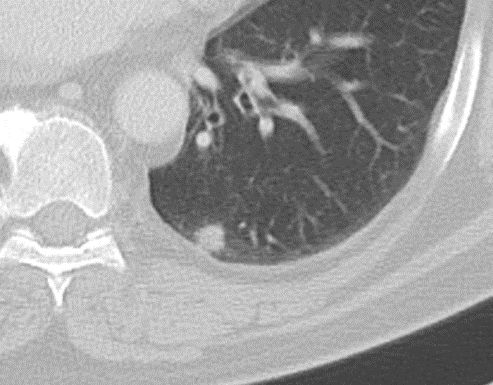
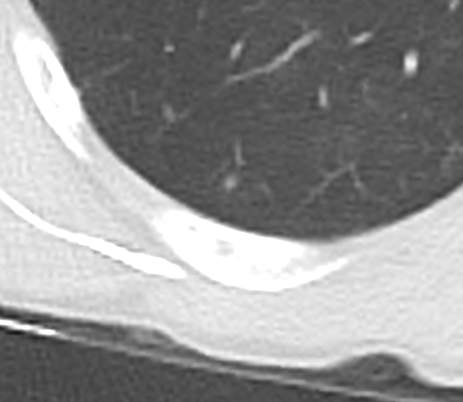
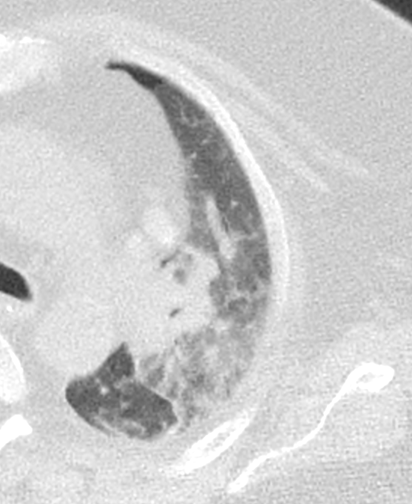
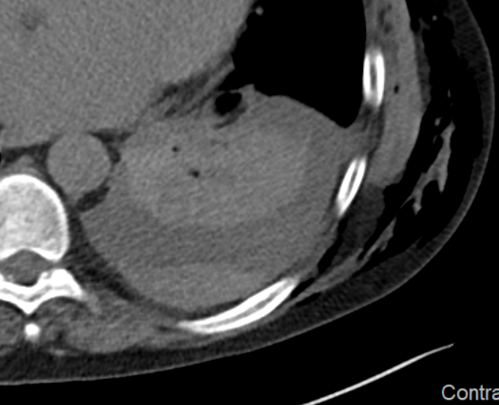
Konsolidierung
Definition:
- Konsolidierungen sind im Gegensatz zu Atelektasen nicht volumengemindert und häufiger unscharf berandet. Stellen Sie sich vor, dass in einer Konsolidierung die Luft im Alveolarraum durch Flüssigkeit / Mucus / Zelldetritus ersetzt wurde, wohingegen sie bei einer Atelektase einfach entwichen ist bzw. herausgepresst wurde.
- Konsolidierungen sind im Gegensatz zu Atelektasen nicht volumengemindert und häufiger unscharf berandet. Stellen Sie sich vor, dass in einer Konsolidierung die Luft im Alveolarraum durch Flüssigkeit / Mucus / Zelldetritus ersetzt wurde, wohingegen sie bei einer Atelektase einfach entwichen ist bzw. herausgepresst wurde.
DDx:
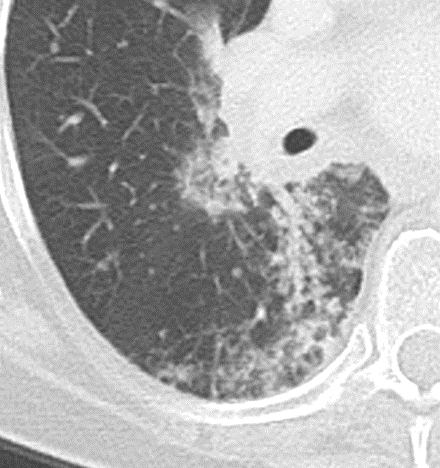
- Die Unterscheidung zwischen Atelektase und Konsolidierung ist häufig schwierig und sicherlich einer der Knackpunkte des RACOON-Templates. Im Rahmen der strukturierten Befundung wird der Begriff Konsolidierung vorrangig für akute pneumonische Veränderungen verwendet, ist also das CT-Korrelat des “Infiltrats” in einem Röntgen-Thorax.
- Aufgrund der höheren Dichte bleiben Konsolidierungen im Gegensatz zu Milchglasarealen im Weichteilfenster sichtbar. Wenn Sie mit der Fenstereinstellung spielen, werden Sie vergleichsweise einfach zwischen beiden Pathologien unterscheiden können. Bei vielen Pneumonien, insb. bei COVID-19, können dichte Konsolidierungen innerhalb subsolider Milchglasinfiltrate beobachtet werden. Dies kann bei eher nachrangigem Anteil der Konsolidierungen auch unter der Rubrik “Milchglasareal” als Zusatz “Konsolidierung innerhalb” befundet werden.
- Im Gegensatz zu Raumforderungen, Rundherden oder Kavernen haben sie keinen rundlichen, herdförmigen bzw. kolonialen Charakter.
- Bronchusverschlüsse durch Mucus/Aspirat, Hämorrhagie, Fremdkörper, Tumor usw. können in Atelektasen, Konsolidierung und Milchglasarealen vorkommen, sind DD deshalb nur wenig hilfreich.
Zusatz:
- “Subpleurale Aussparung” sollte nur dann gewählt werden, wenn die konsolidierten Lungenareale beinahe bis an die Pleura reichen, unmittelbar subpleural aber ein schmaler, max. etwa 1 cm breiter Saum belüftetes Lungenparenchym sichtbar bleibt.
- Liegt innerhalb der Läsion ein zentral dichtegemindertes (flüssigkeitsdichtes) Areal, oder eine extraanatomische Gasansammlung vor, ist von einer zentralen Einschmelzung auszugehen. Hierbei hilft häufig das Weichteilfenster zur Identifikation einer Einschmelzung. Konsolidierung “mit Einschmelzung” wird in den meisten Fällen eine abszedierende Pneumonie bedeuten. Innerhalb eines konsolidierten Lungenareals sollen dann eindeutig extraanatomische Lufteinschlüsse sichtbar sein, die also weder dem physiologischen Bronchialsystem, noch erhaltenen sekundären Lobuli zuzuordnen sind. Sichtbare, pathologische Bronchusanschlüsse können bei beiden Pathologien vorkommen.
- CAVE: Macht die Einschmelzung mehr als 50% des individuellen Läsionsvolumens aus, wird dies als Kavität/Kavitation klassifiziert. Die Abgrenzung zur zentral belüfteten Kavitation (Kapitel 6) ist schwierig. Eine schwere Pneumonie mit abszedierenden Einschmelzungen ist eher eine Konsolidierung mit luftgefüllten Anteilen und wird häufig mit einem Pleuraerguss einhergehen. Kavitäten unterschiedlicher Genese entsprechen hingegen eher Raumforderungen oder Rundherden mit luftgefüllten Anteilen, sind also meistens rundlich und abgekapselt konfiguriert.
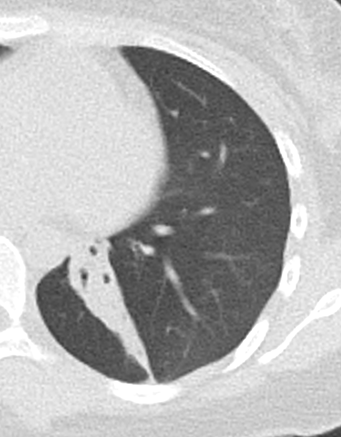
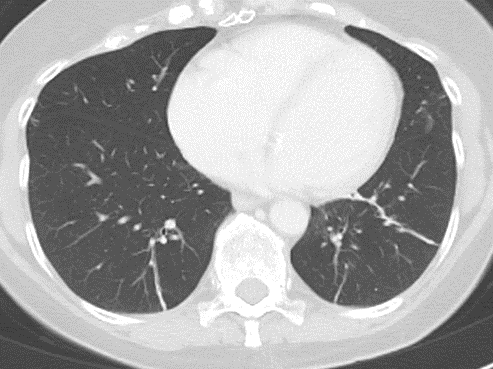
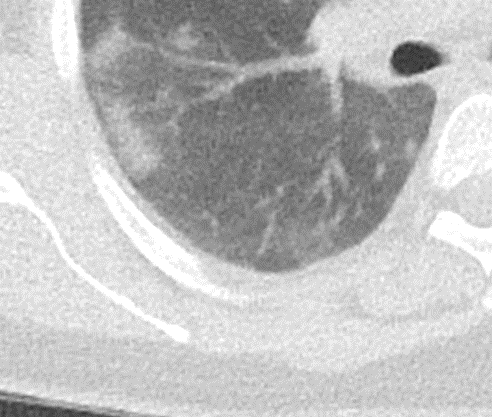
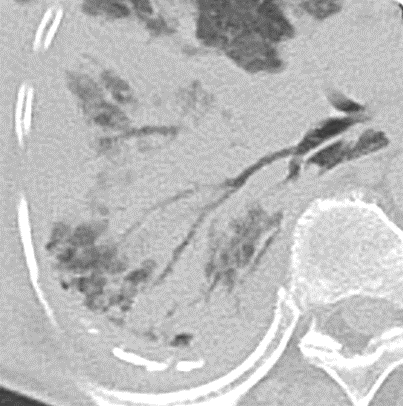
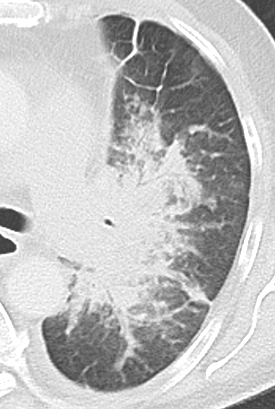
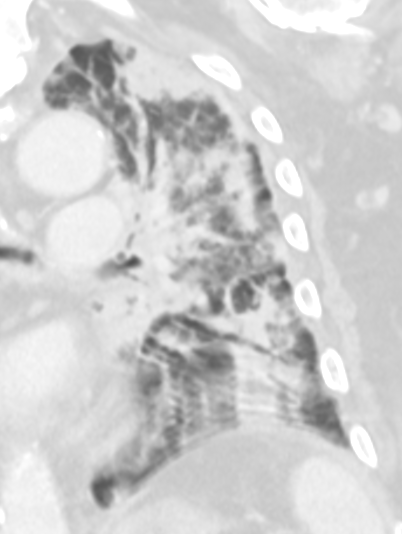
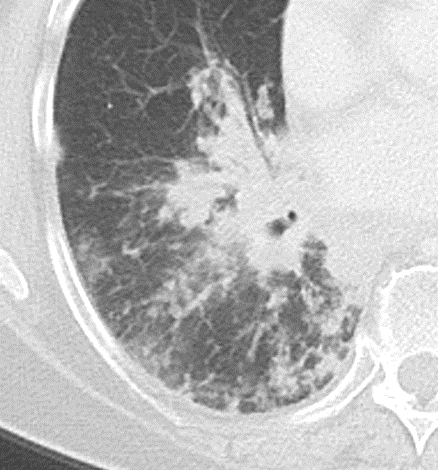
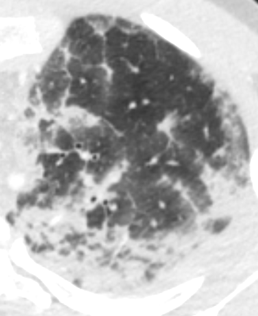
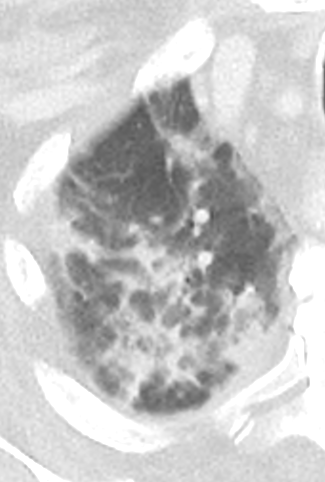
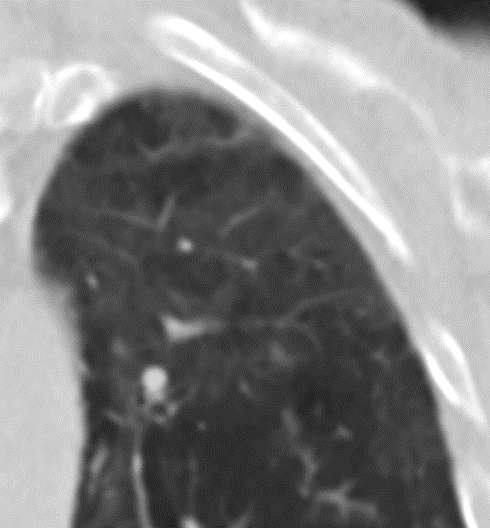
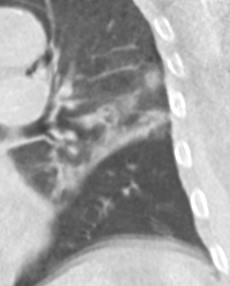
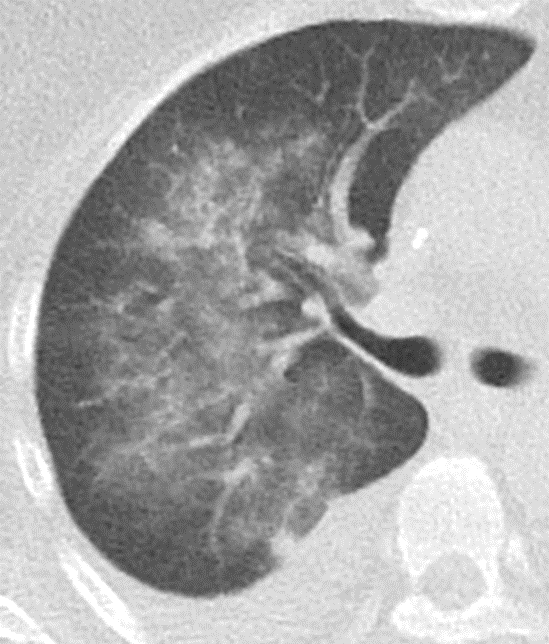
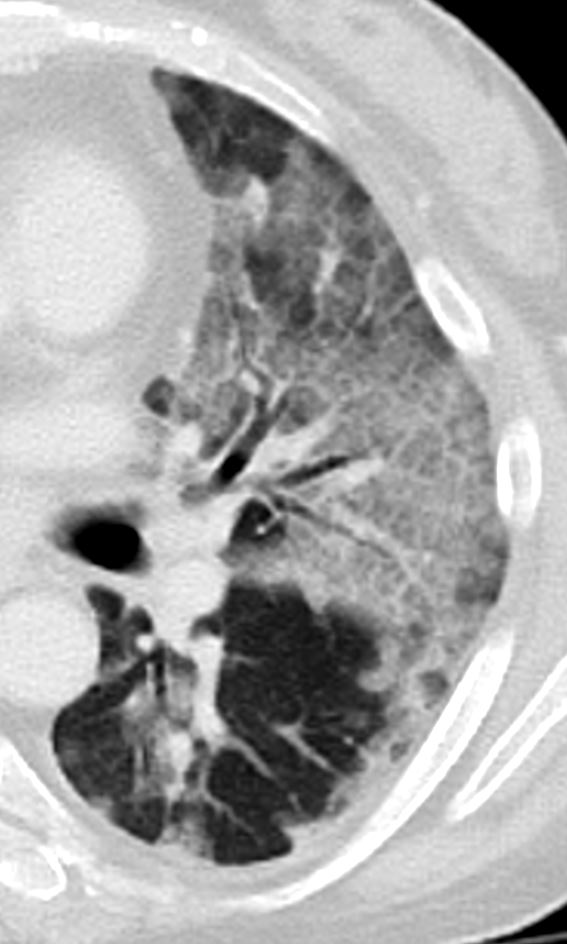
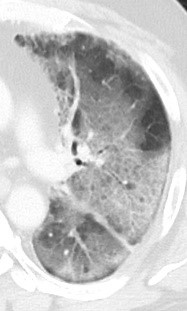
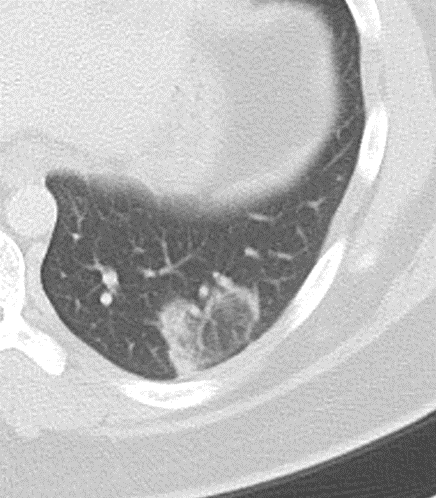
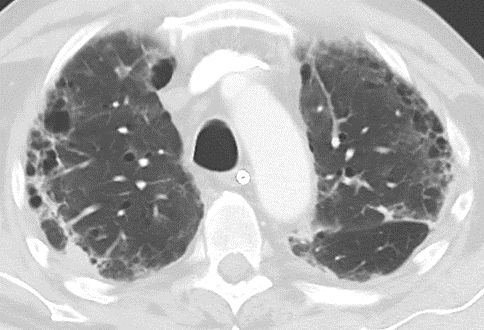
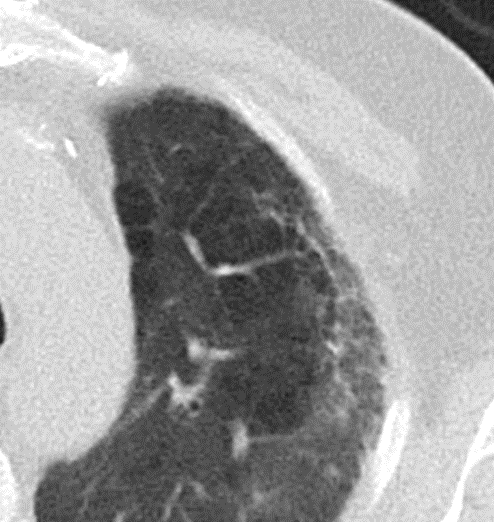
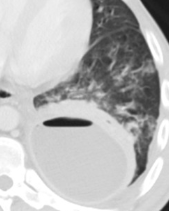
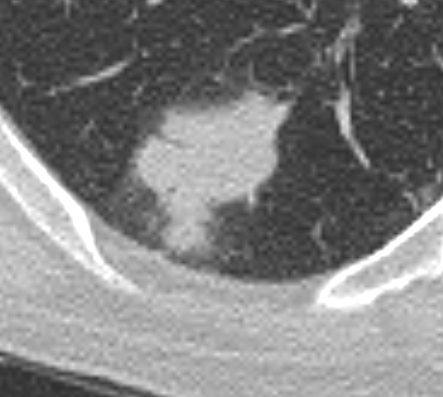
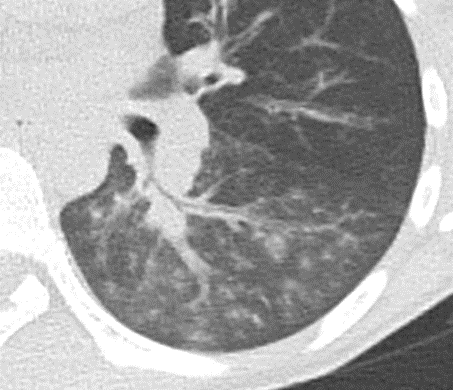
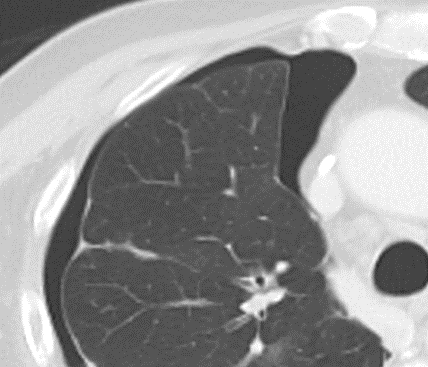
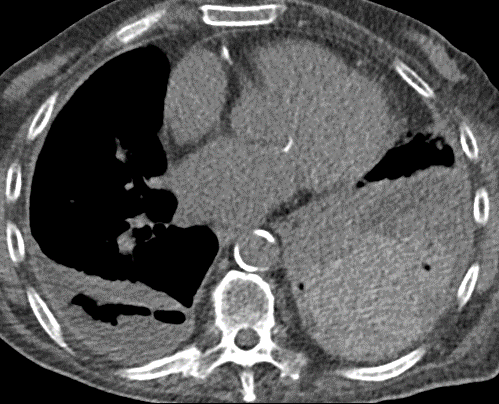
Milchglasareal
Definition / DDx:
- Stellen Sie sich (grob vereinfacht!) vor, dass in einer Konsolidierung die Luft im Alveolarraum vollständig durch Flüssigkeit / Mucus / Zelldetritus ersetzt wurde, wohingegen in einem Milchglasareal mehr oder weniger große Flüssigkeitsspiegel in den Alveolen stehen, das Interstitium Flüssigkeit oder Gewebe eingelagert hat, oder sich das kapilläre Blutvolumen erhöht hat. Dieses gedankliche Konstrukt kann helfen zu verstehen, weshalb sich Milchglasareale bei einer Befundverschlechterung nahtlos zu Konsolidierungen verdichten können.
- Milchglasareale weisen im Vergleich mit Konsolidierungen deutlich geringere CT-Dichten auf und sind deshalb in einem normalen Weichteilfenster nicht sichtbar. In diesen Bereichen sollte das Lungenparenchym homogen dunkel erscheinen.
- Innerhalb von Milchglasarealen sollen anatomische Strukturen wie Gefäße, Bronchien und Lappenspalten noch abgrenzbar sein, wohingegen diese innerhalb einer Konsolidierung maskiert sind.
Zusatz:
- “Subpleurale Aussparung“ bitte nur wählen, wenn diese nur zu vernachlässigbaren Anteilen unterbrochen ist.
- “Crazy paving” bezeichnet Milchglasareale mit verdickten interlobulären Septen, also die Kombination aus alveolären und interstitiellen Flüssigkeitseinlagerungen. In diesen Bereichen muss zwingend auch die Pathologie “Retikulationen” (Kapitel 5) ausgewählt werden.
- Das “Vakuolenzeichen” entsteht, wenn einzelne normale, frei belüftete sekundäre Lobuli komplett von Milchglasarealen eingeschlossen sind.
- Das “Reversed Halo” oder auch “Atoll-Zeichen” bezeichnet Milchglasherde, die von einem mehr oder weniger runden Saum aus konsolidiertem Lungenparenchym umschlossen sind.
- “Hyperämie” bedeutet ausschließlich innerhalb der Milchglasareale verdickte und im gesunden Lungenparenchym normale Gefäße.
- Bei fast allen Pneumonien, insb. bei COVID-19, können dichte Konsolidierungen innerhalb subsolider Milchglasinfiltrate beobachtet werden. Unser Tipp: Markieren Sie zunächst das größere Milchglasareal. Vergessen Sie den Zusatz “Konsolidierung innerhalb” nicht. Wechseln Sie dann ins Weichteilfenster und markieren Sie die Konsolidierungen innerhalb des Milchglases.
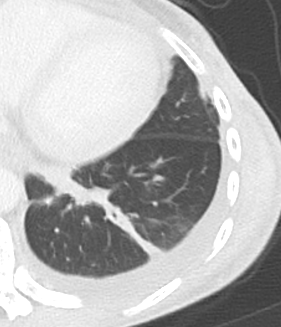
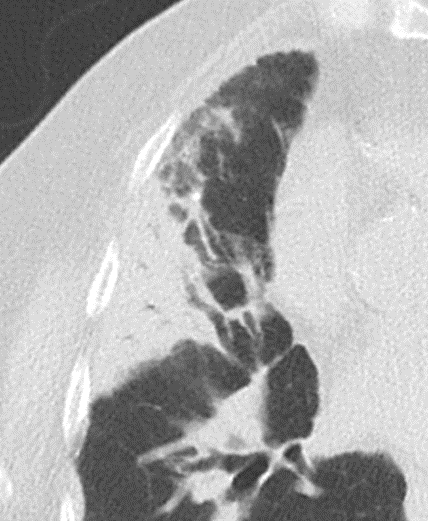
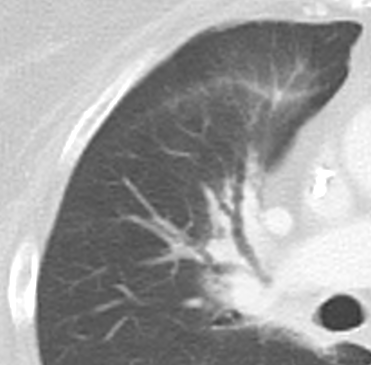
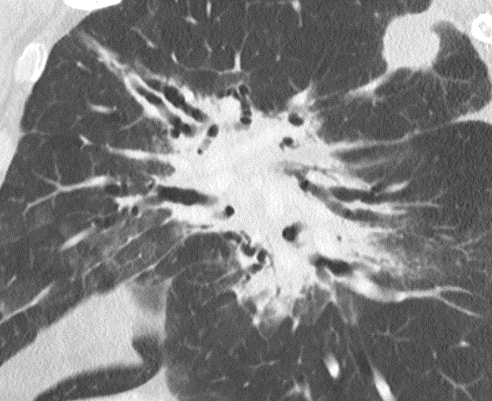
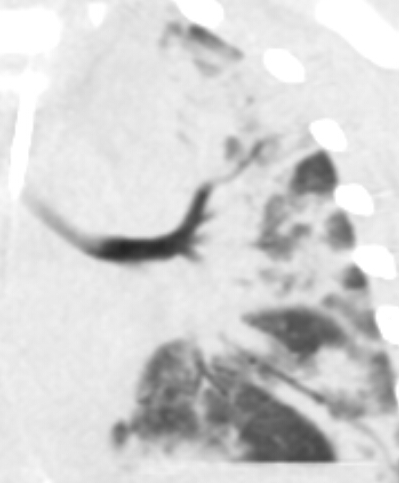
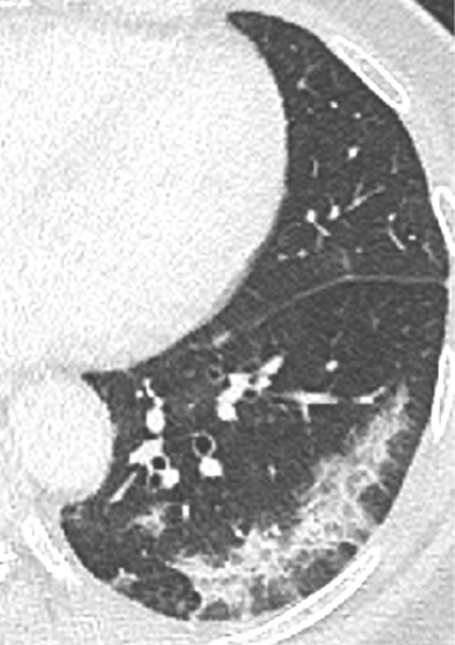
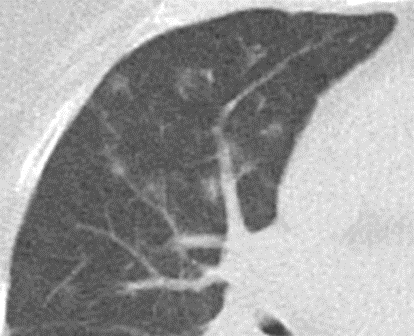
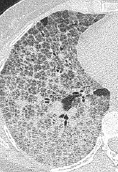
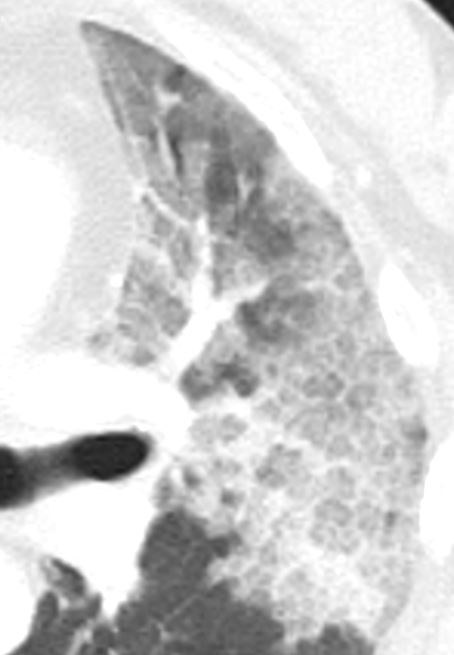
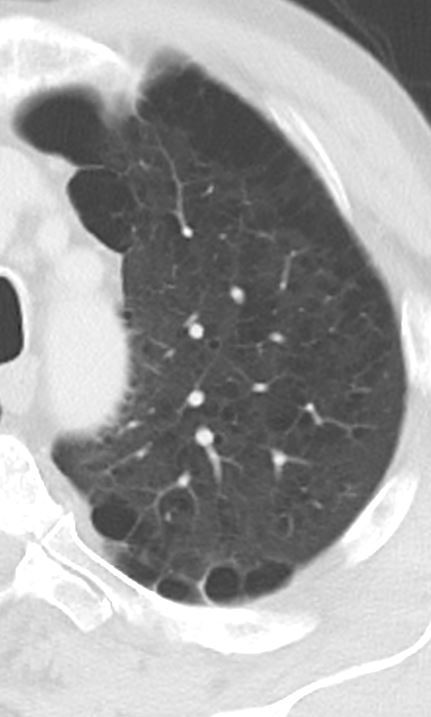
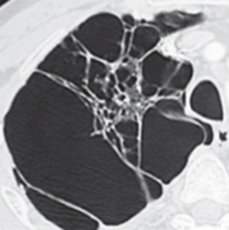
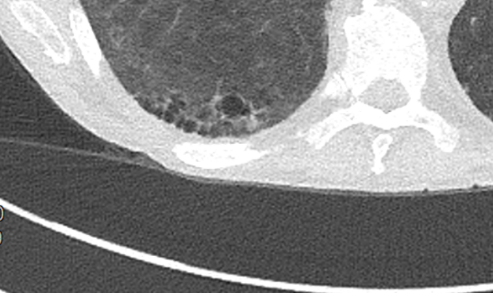
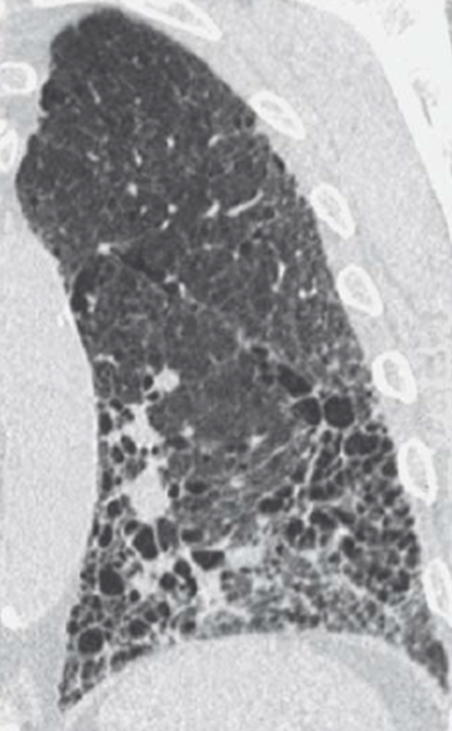
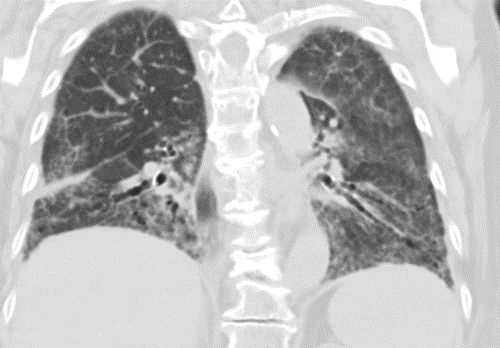
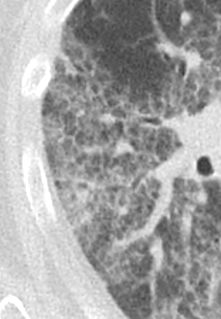
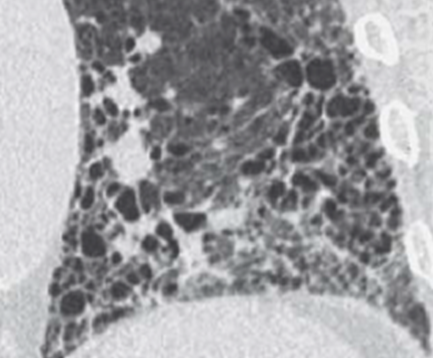
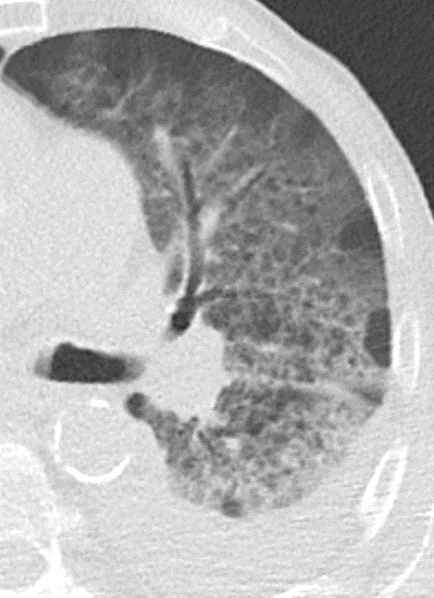
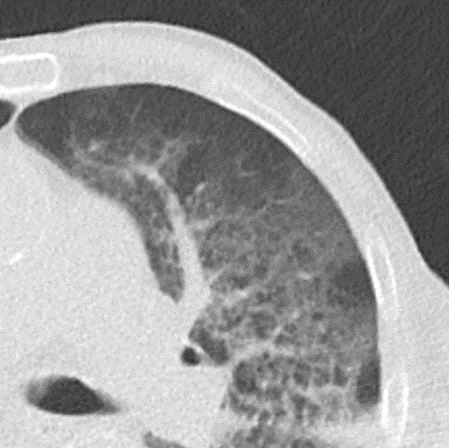
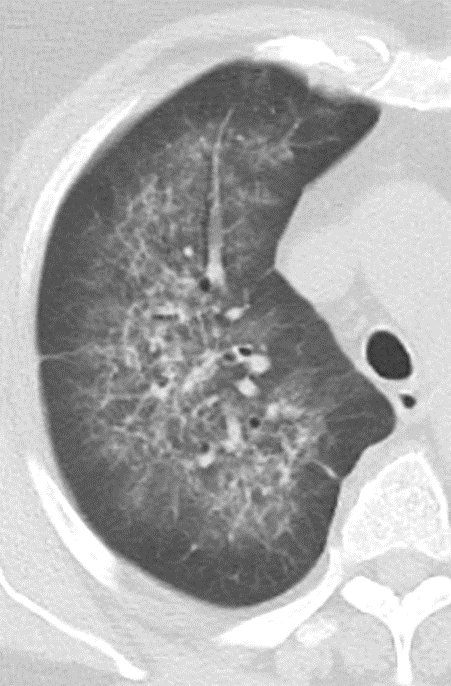
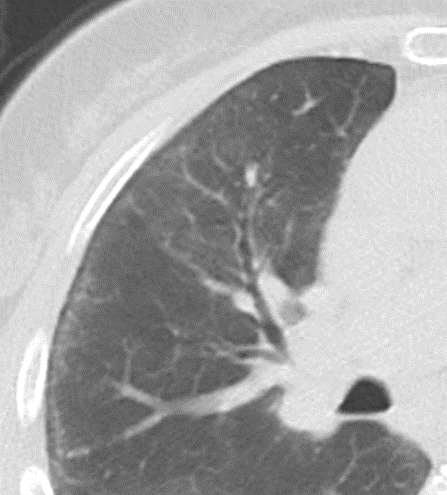
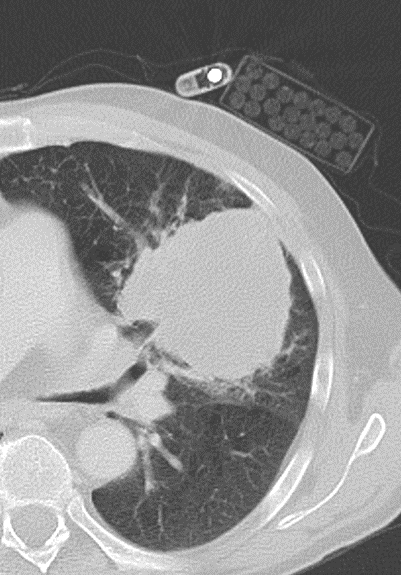
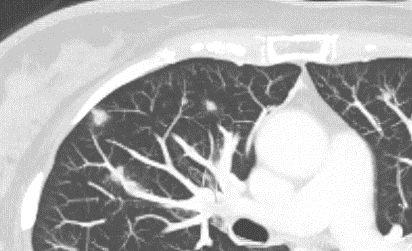
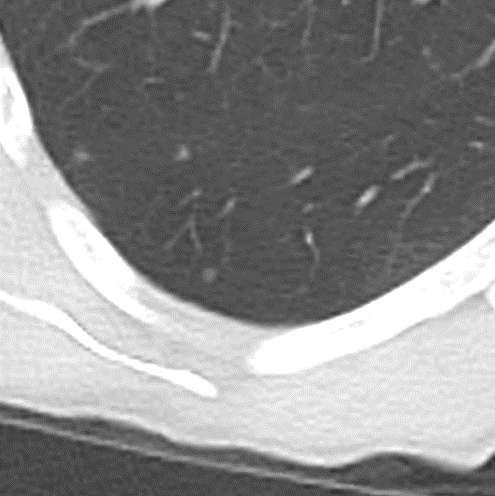
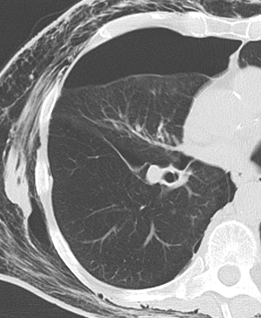
Emphysem
Definition/ Schweregrad:
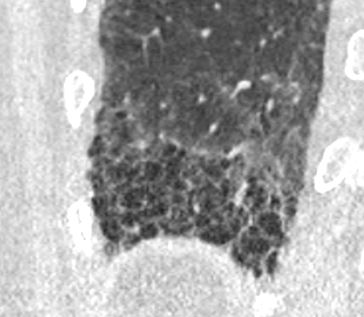
- Die Entwicklung eines Lungenemphysems beginnt bei den meisten Formen zentrilobulär. Ein geringer Schweregrad beginnt und zeigt sich also lediglich zentral, d.h. um den respiratorischen Bronchiolus herum dichtegeminderten sekundären Lobuli. Im Verlauf der Erkrankung breitet sich das Emphysem vom Zentrum des Lobulus zu den interlobulären Septen hin aus, bis alle Alveolen und Azini destruiert sind und der gesamte Lobulus homogen dichtegemindert ist.
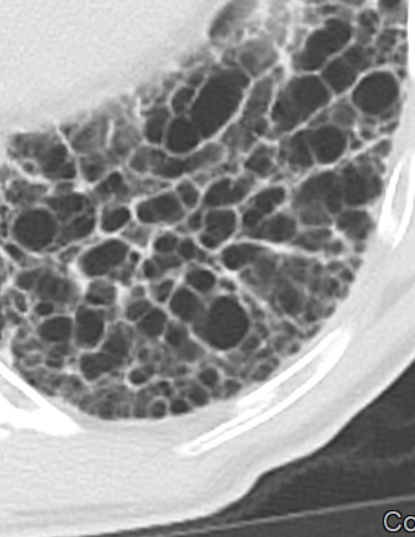
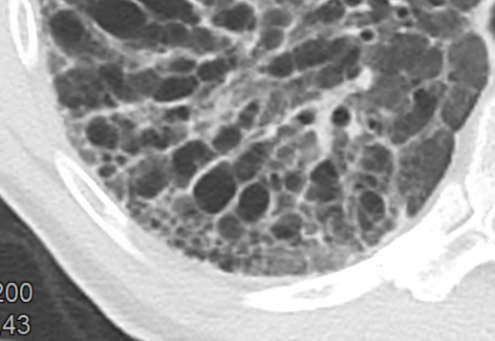
- Sind mehrere benachbarte Lobuli vollständig betroffen, liegt ein konfluierendes Emphysem vor. Zwischen den konfluierten Arealen können Inseln von gesundem Parenchym, manchmal sogar vollständig intakte Lobuli, erhalten sein. Die interlobulären Septen zwischen den Lobuli sollen noch abgrenzbar sein.
- Die Maximalvariante ist das destruierende Emphysem, bei dem die interlobulären Septen zerrissen sind und die normale Anatomie des Lungenparenchyms aufgehoben ist.
- Die Sonderform des sogenannten panlobulären Emphysems im Rahmen eines α1-Antitrypsinmangels kann in der CT nicht vom destruierenden Emphysem differenziert werden und sollte daher als solches dokumentiert werden. Das panlobuläre Emphysem ist fast immer basal betont.
DDx:
- Die Unterscheidung zwischen emphysematischen und zystischen Veränderungen kann selbst für Experten schwierig sein. Pneumozysten / Pneumatozelen sind anders als Emphysemareale von einer dünnen Wand umgeben und finden sich in RACOON als Kavitation mit dem Zusatz “dünnwandig” (Kapitel 6). Zystische Lungenerkrankungen sind sehr viel seltener als Emphyseme, können aber durch schwere Pneumonien entstehen. Achten Sie darauf, ob die Lunge insgesamt überbläht ist (eher Emphysem) und ob sich dünnwandig umkapselte Aufhellungen zeigen, die deutlich zu klein oder groß für emphysematisch veränderte sekundäre Lobuli sind (eher Zysten).
- Die Unterscheidung zwischen emphysematischen und zystischen Veränderungen kann selbst für Experten schwierig sein. Pneumozysten / Pneumatozelen sind anders als Emphysemareale von einer dünnen Wand umgeben und finden sich in RACOON als Kavitation mit dem Zusatz “dünnwandig” (Kapitel 6). Zystische Lungenerkrankungen sind sehr viel seltener als Emphyseme, können aber durch schwere Pneumonien entstehen. Achten Sie darauf, ob die Lunge insgesamt überbläht ist (eher Emphysem) und ob sich dünnwandig umkapselte Aufhellungen zeigen, die deutlich zu klein oder groß für emphysematisch veränderte sekundäre Lobuli sind (eher Zysten).
Zusatz:
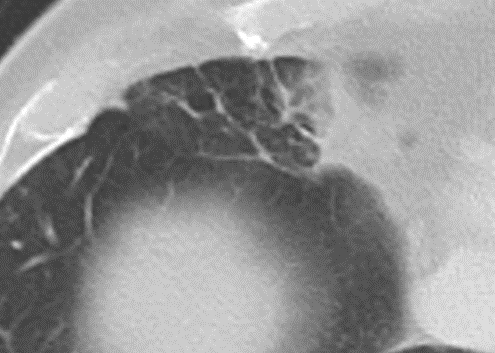
- Das paraseptale Emphysem ist subpleural lokalisiert, folgt also auch den Lappenspalten. Paraseptal ist nicht dasselbe wie peripher!
- Bullae müssen mindestens 1 cm Durchmesser haben und sind im Gegensatz zum destruierenden Emphysem von einer hauchdünnen Wand erhaltener Septen umschlossen und meistens rundlich konfiguriert
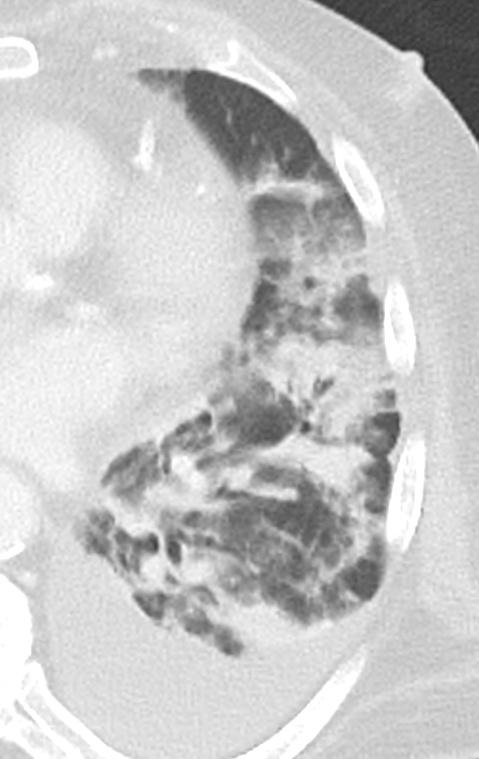
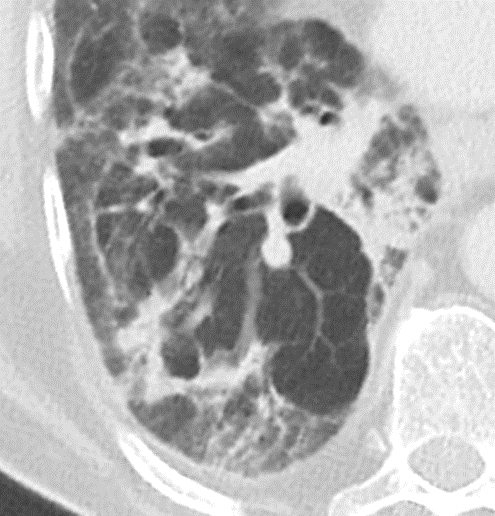
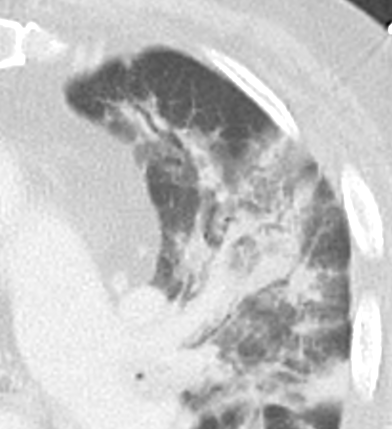
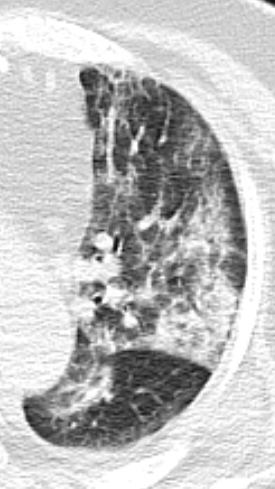
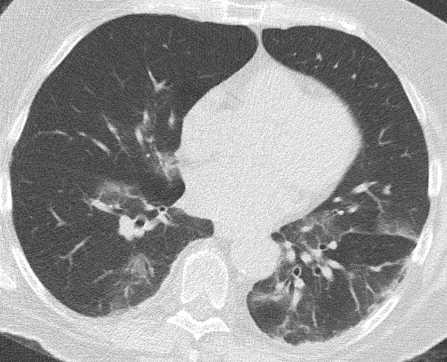
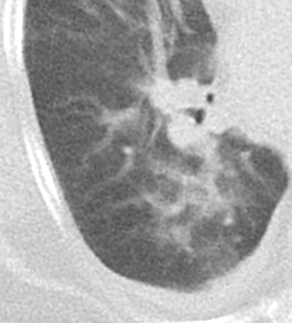
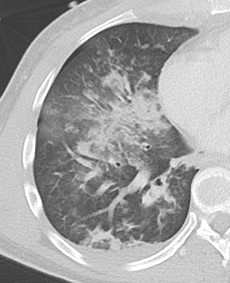
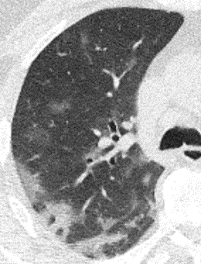
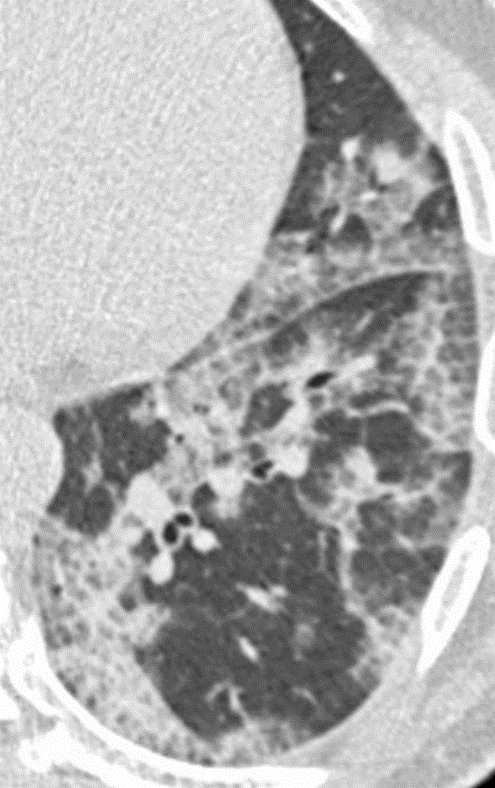
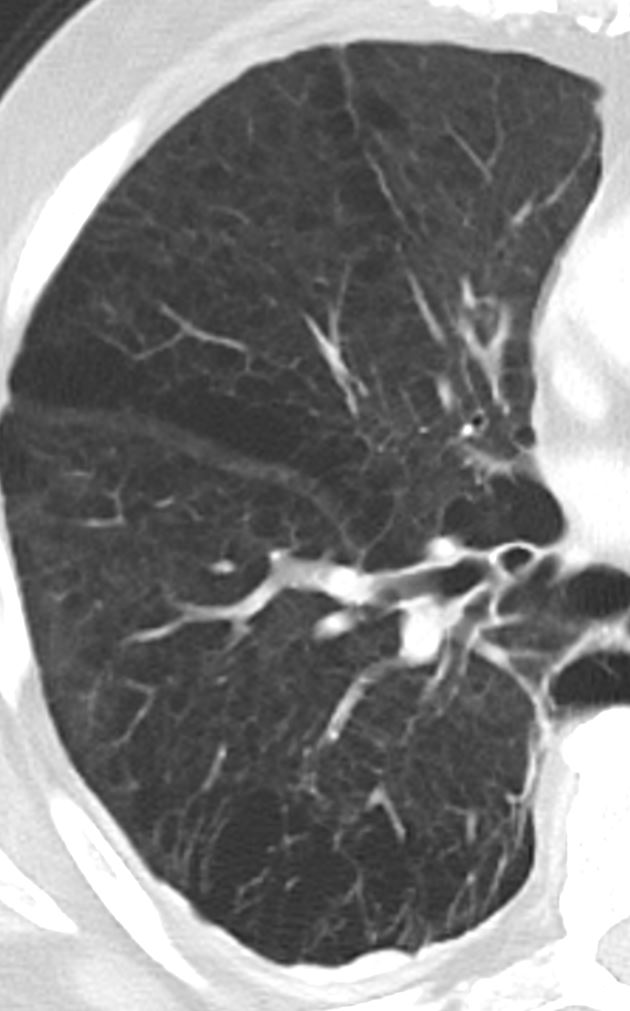
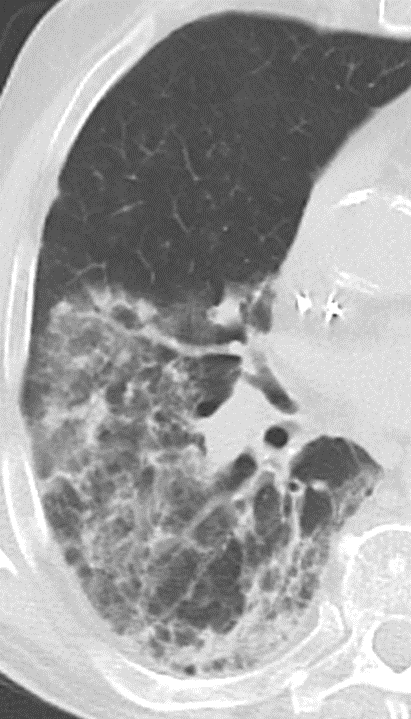
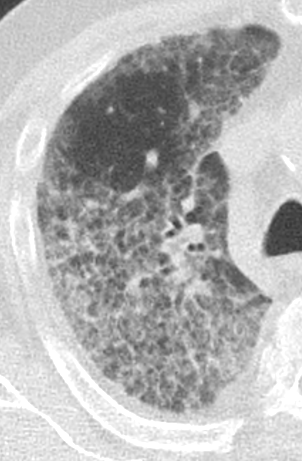
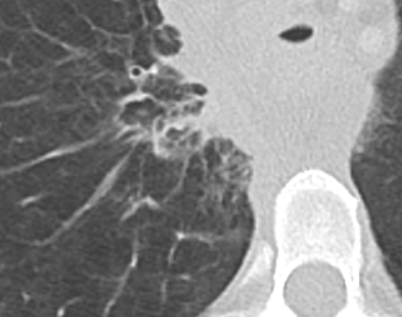
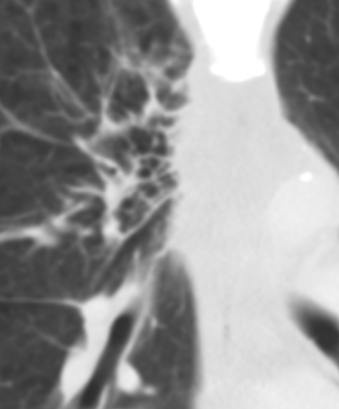
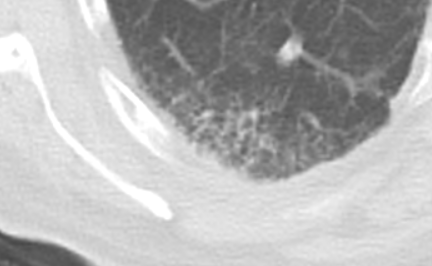
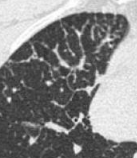
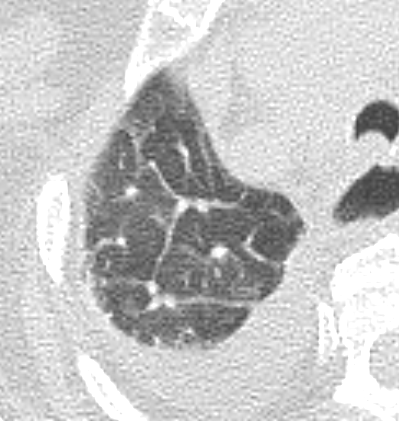
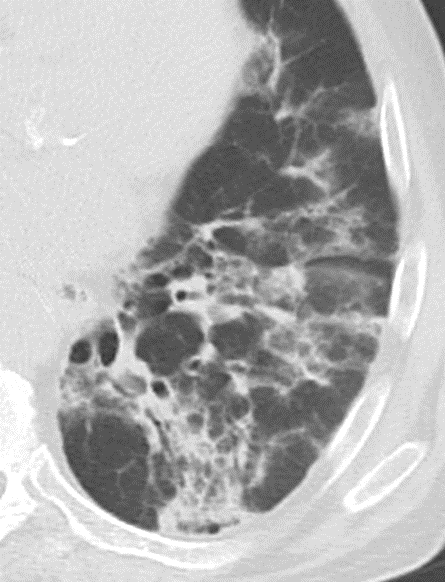
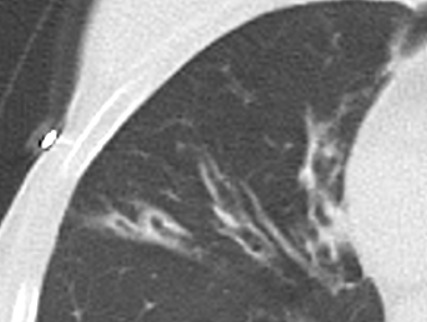
Retikulation
Definition:
- Als Retikulation werden sowohl Verdickungen der interlobulären als auch der intralobulären Septen dokumentiert.
- Als Retikulation werden sowohl Verdickungen der interlobulären als auch der intralobulären Septen dokumentiert.
Verteilung anatomisch:
- „Peribronchiale“ Retikulationen orientieren sich entlang des bronchovaskulären Bündels.
- „Perilymphatische“ Retikulationen betreffen vorwiegend die interlobulären Septen, die Pleura visceralis und damit auch die Interlobien.
- „Intralobuläre“ Retikulationen bezeichnen eine meist feinretikuläre Zeichnungsvermehrung innerhalb interlobulärer Septen.
- “Kein Muster” meint hier eine Überlagerung mehrerer Verteilungen oder eine so weitgehende (fibrotische) Destruktion des Lungenparenchyms, dass die Zuordnung der Retikulationen zu den anatomischen Regionen nicht mehr möglich ist.
Zusatz:
- Die „subpleurale Aussparung“ kann wenige mm bis einige cm betragen, sollte jedoch mehrheitlich nicht durchbrochen sein.
- „Honeycombing“ bedeutet (honig-)wabenartig fibrotisch umgebautes Lungenparenchym, in dem dicke fibrotische Wände zystische Lufteinschlüsse umschließen.
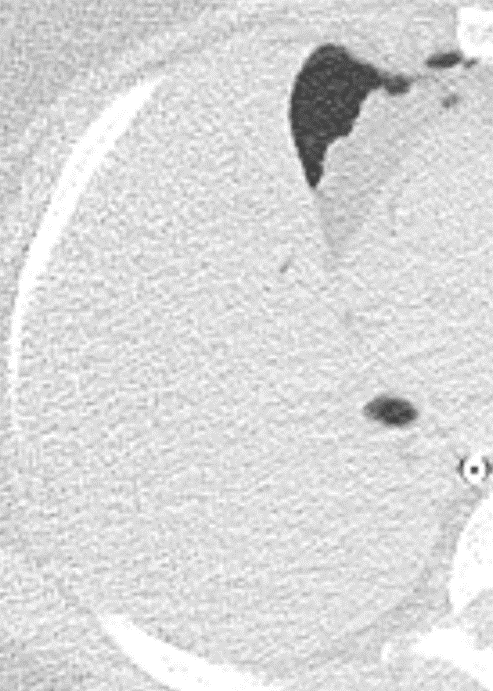
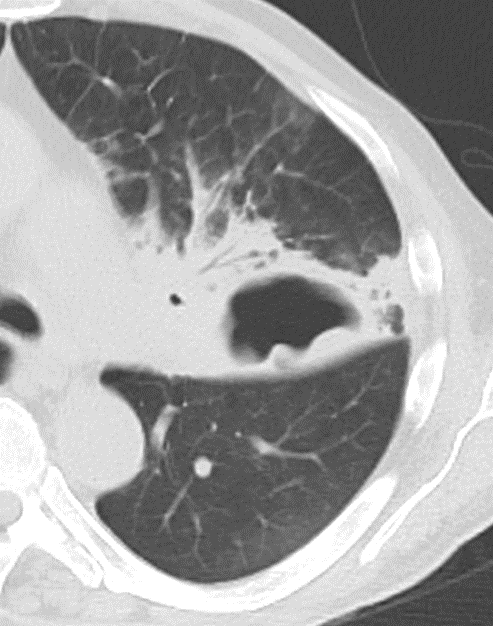
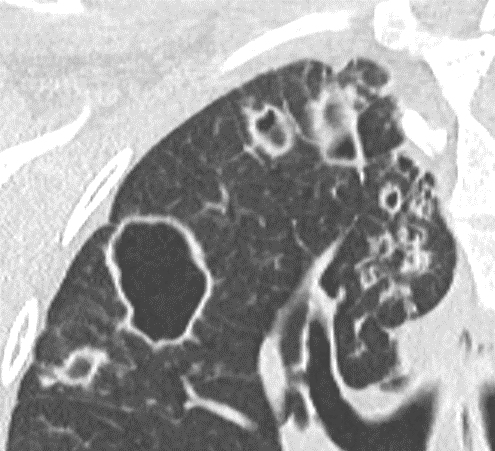
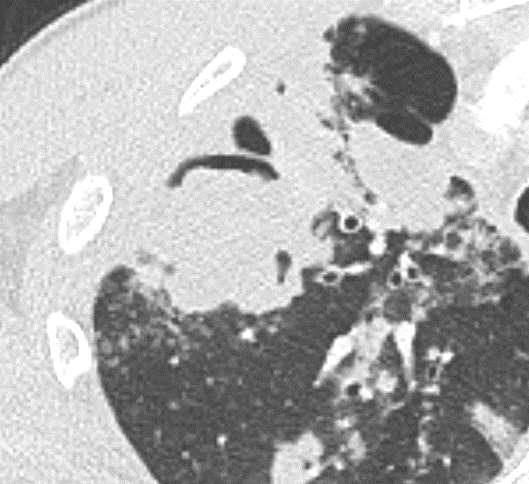
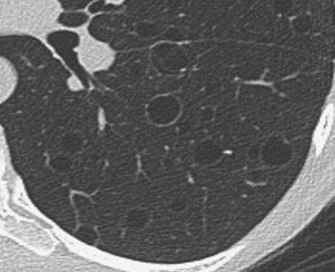
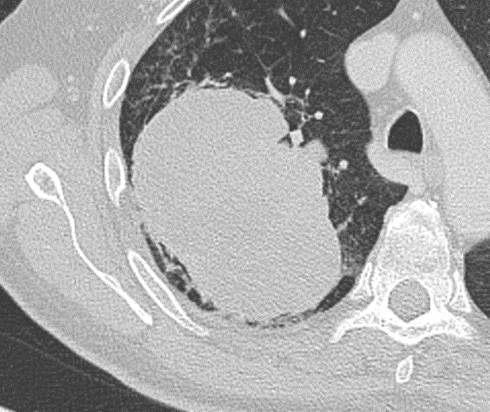
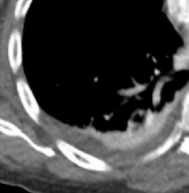
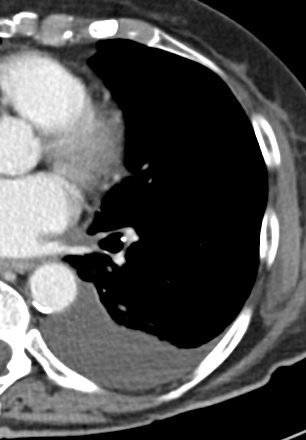
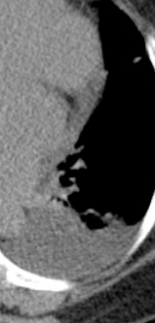
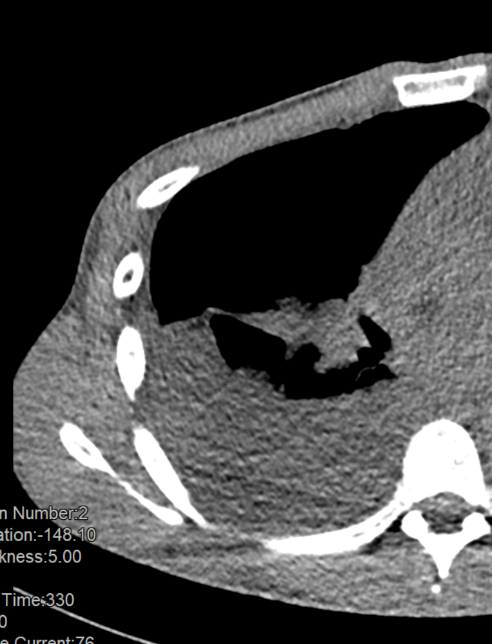
Kavitation
Definition:
- Als Kavitation oder Kavität ist ein von einer mehr oder weniger dicken Wand umschlossener, luftgefüllter Hohlraum innerhalb des Lungenparenchyms definiert.
- In Abgrenzung zur Konsolidierung mit Einschmelzung sollte bei einer dickwandigen Kavitation das nekrotisch-avaskuläre und mit Luft und/oder Flüssigkeit gefüllte Zentrum größer als die umgebende Verdichtung / Kapsel sein.
- Bitte achten Sie auf die korrekte Nomenklatur gemäß des Fleischner-Glossars. Der Begriff „Kaverne“ ist für Kavitäten reserviert, die durch eine Lungentuberkulose verursacht wurden.
Zusatz:
- Durch Flüssigkeit in einer Kavität entstehen „Luft-Flüssigkeitsspiegel“. Bei einer üblicherweise in Rückenlage durchgeführten Thorax-CT sammelt sich die spiegelbildende Flüssigkeit dorsalseitig.
- Ist die Kavität mit festem Material ausgefüllt entsteht das „Luftsichel- bzw. Crescent-Zeichen“.
- Rundlich einen Herdbefund umgebende milchglasdichte Belüftungsstörungen werden als „Halo“ (engl. „Heiligenschein“) bezeichnet.
- „Dünnwandige/zystische“ Kavitationen bezeichnen in RACOON Pneumatozelen, also luftgefüllte Lungenzysten, bei denen ein gasgefüllter Hohlraum durch eine dünne Wand vom umgebenden Lungenparenchym separiert ist. Sie sind von emphysematischen Bullae (keine oder nur hauchdünne Wände) und von Kavitationen (dicke Wände) zu unterscheiden. Pneumatozelen werden relativ häufig als postpneumonische Residuen, z.B. als Folge einer Überdruckbeatmung, oder posttraumatisch beobachtet.
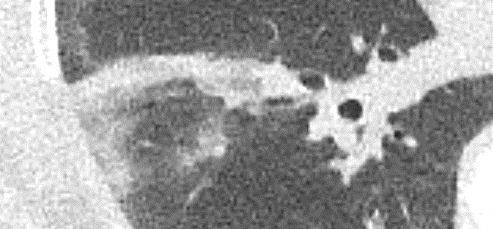
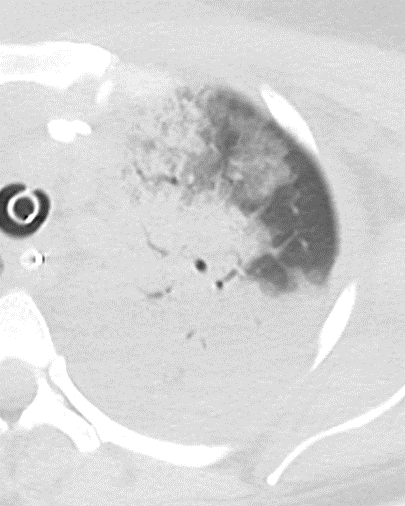
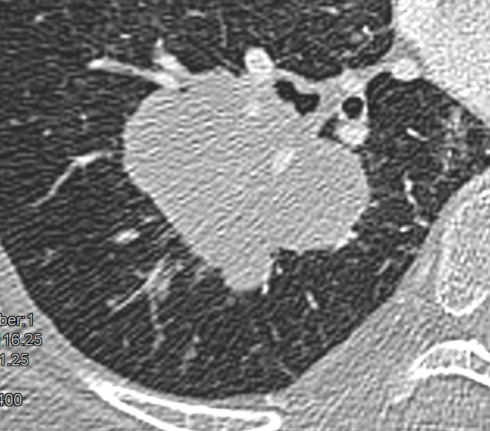
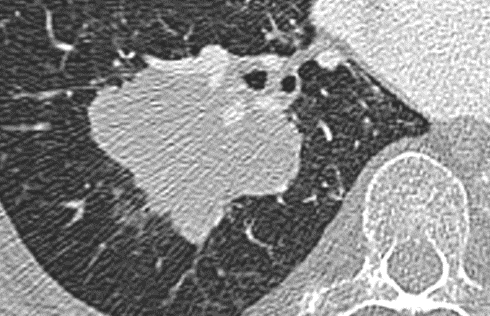
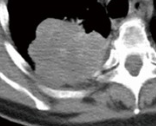
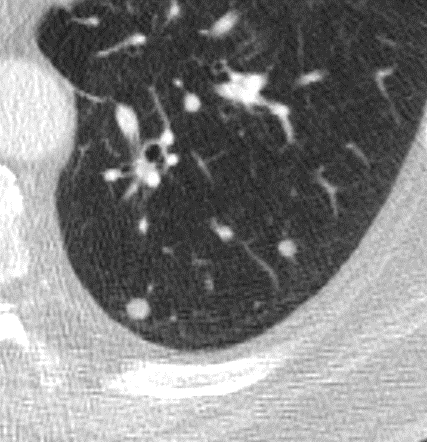
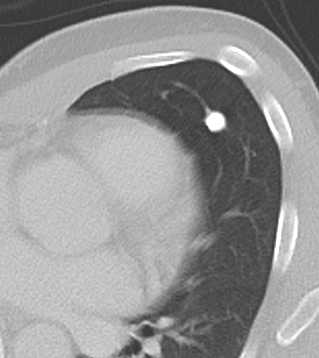
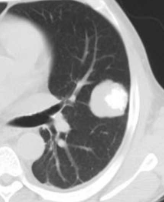
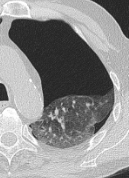
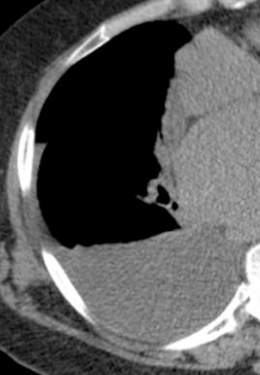
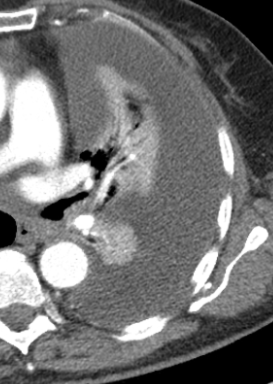
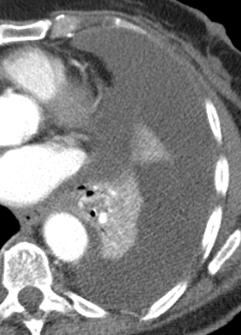
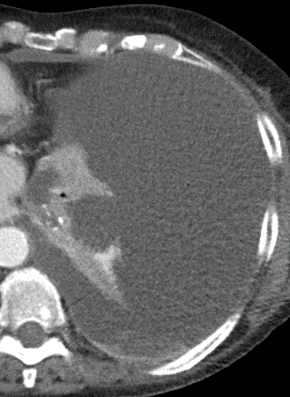
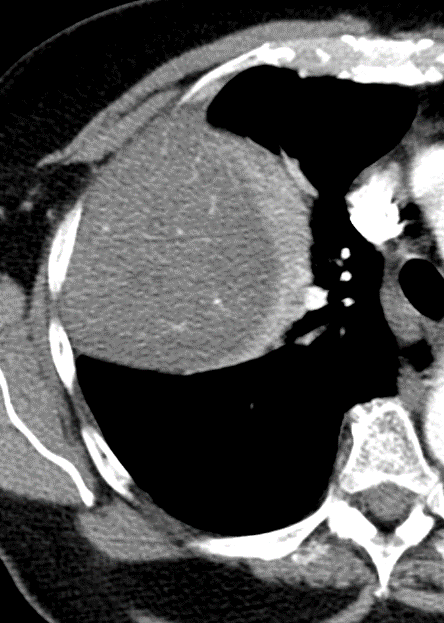
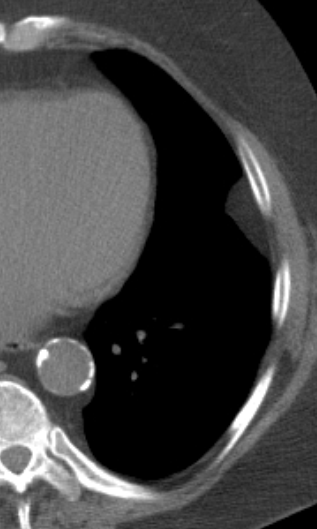
Raumforderung
Definition:
- Die Pathologien 7, 8 und 9 bezeichnen mehr oder weniger rundliche pulmonale Herdverdichtungen in absteigender Größe.
- Eine Raumforderung muss im größten Durchmesser mehr als 3 cm aufweisen. In Abgrenzung zur Konsolidierung ist ihre Form eher rund, vergleichbar zu einer Kolonie wachsender organfremder Zellen.
*Rundherd, Knoten und Nodulus sind synonyme Begriffe. Um schnell optisch zwischen den Themengebieten unterscheiden zu können, wird im RACOON Atlas der Begriff ‘Nodulus’ für kleine Läsionen <5mm genutzt, ‘Rundherd/Knoten’ hingegen für größere Läsionen von 5-30mm.
Zusatz:
- Partiell solide, also im Weichteilfenster noch anteilig abgrenzbare Herde sollen unter „semisolide“ dokumentiert werden. Noduli < 5 mm können in dickeren Schichten aufgrund des Partialvolumeneffekts fälschlicherweise nicht-solide wirken. Deshalb sollten bei mikronodulären Veränderungen immer Dünnschichtserien von max. 1,5 mm (besser: 1 mm) Schichtdicke für die Beurteilung verwendet werden.
- „Unscharf“ übersetzt in RACOON den englischen Begriff „ill-defined“. Damit sollen ausgefranste und spikulierte pulmonale Herdbefunde kodiert werden, die aufgrund ihrer Randbeschaffenheit nicht wie klassische scharfrandige Metastasen oder Granulome aussehen, sondern eher suggestiv für floride entzündliche Läsionen oder lokal infiltrierende maligne Herde sind.
- Einschmelzungen in Raumforderungen, Rundherden oder Noduli < 5 mm betreffen kleinere Anteile von <50% der Läsion. Wichtig ist die Abgrenzung zu Kavitationen (Kapitel 6), bei denen mindestens 50% des Volumens mit Luft oder Flüssigkeit gefüllt sein sollten.
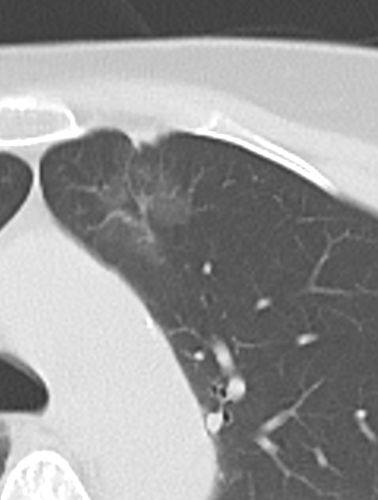
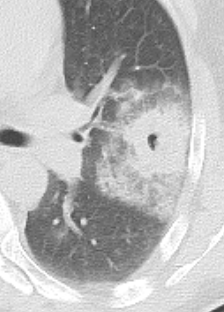
Rundherd/Knoten
Diese Info ist identisch zur Info in 7. Raumforderung
Definition:
- Die Pathologien 7, 8 und 9 bezeichnen mehr oder weniger rundliche pulmonale Herdverdichtungen in absteigender Größe.
- Eine Raumforderung muss im größten Durchmesser mehr als 3 cm aufweisen. In Abgrenzung zur Konsolidierung ist ihre Form eher rund, vergleichbar zu einer Kolonie wachsender organfremder Zellen.
*Rundherd, Knoten und Nodulus sind synonyme Begriffe. Um schnell optisch zwischen den Themengebieten unterscheiden zu können, wird im RACOON Atlas der Begriff ‘Nodulus’ für kleine Läsionen <5mm genutzt, ‘Rundherd/Knoten’ hingegen für größere Läsionen von 5-30mm.
Zusatz:
- Partiell solide, also im Weichteilfenster noch anteilig abgrenzbare Herde sollen unter „semisolide“ dokumentiert werden. Noduli < 5 mm können in dickeren Schichten aufgrund des Partialvolumeneffekts fälschlicherweise nicht-solide wirken. Deshalb sollten bei mikronodulären Veränderungen immer Dünnschichtserien von max. 1,5 mm (besser: 1 mm) Schichtdicke für die Beurteilung verwendet werden.
- „Unscharf“ übersetzt in RACOON den englischen Begriff „ill-defined“. Damit sollen ausgefranste und spikulierte pulmonale Herdbefunde kodiert werden, die aufgrund ihrer Randbeschaffenheit nicht wie klassische scharfrandige Metastasen oder Granulome aussehen, sondern eher suggestiv für floride entzündliche Läsionen oder lokal infiltrierende maligne Herde sind.
- Einschmelzungen in Raumforderungen, Rundherden oder Noduli < 5 mm betreffen kleinere Anteile von <50% der Läsion. Wichtig ist die Abgrenzung zu Kavitationen (Kapitel 6), bei denen mindestens 50% des Volumens mit Luft oder Flüssigkeit gefüllt sein sollten.
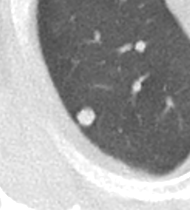
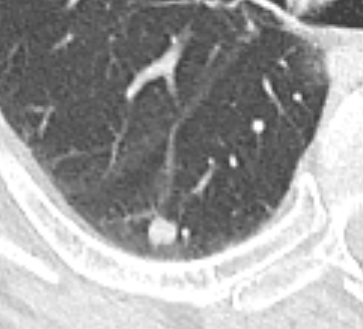
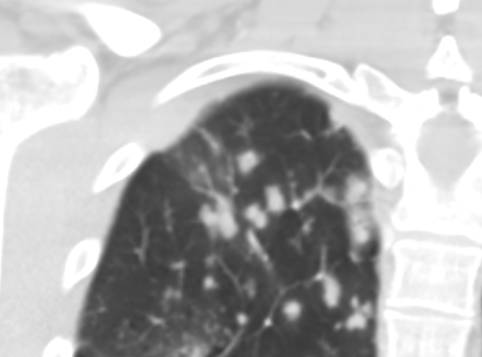
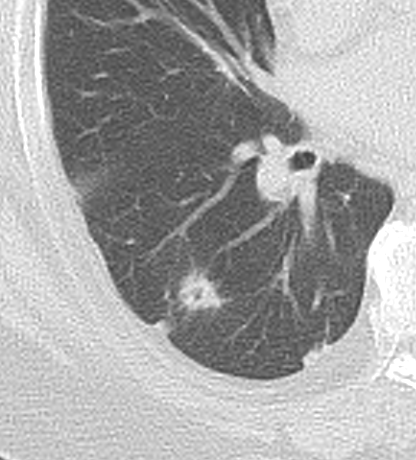
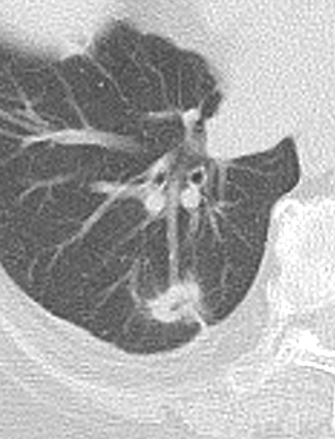
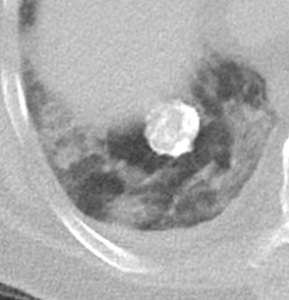
Nodulus <5mm
Diese Info ist identisch zur Info in 7. Raumforderung
Definition:
- Die Pathologien 7, 8 und 9 bezeichnen mehr oder weniger rundliche pulmonale Herdverdichtungen in absteigender Größe.
- Eine Raumforderung muss im größten Durchmesser mehr als 3 cm aufweisen. In Abgrenzung zur Konsolidierung ist ihre Form eher rund, vergleichbar zu einer Kolonie wachsender organfremder Zellen.
*Rundherd, Knoten und Nodulus sind synonyme Begriffe. Um schnell optisch zwischen den Themengebieten unterscheiden zu können, wird im RACOON Atlas der Begriff ‘Nodulus’ für kleine Läsionen <5mm genutzt, ‘Rundherd/Knoten’ hingegen für größere Läsionen von 5-30mm.
Zusatz:
- Partiell solide, also im Weichteilfenster noch anteilig abgrenzbare Herde sollen unter „semisolide“ dokumentiert werden. Noduli < 5 mm können in dickeren Schichten aufgrund des Partialvolumeneffekts fälschlicherweise nicht-solide wirken. Deshalb sollten bei mikronodulären Veränderungen immer Dünnschichtserien von max. 1,5 mm (besser: 1 mm) Schichtdicke für die Beurteilung verwendet werden.
- „Unscharf“ übersetzt in RACOON den englischen Begriff „ill-defined“. Damit sollen ausgefranste und spikulierte pulmonale Herdbefunde kodiert werden, die aufgrund ihrer Randbeschaffenheit nicht wie klassische scharfrandige Metastasen oder Granulome aussehen, sondern eher suggestiv für floride entzündliche Läsionen oder lokal infiltrierende maligne Herde sind.
- Einschmelzungen in Raumforderungen, Rundherden oder Noduli < 5 mm betreffen kleinere Anteile von <50% der Läsion. Wichtig ist die Abgrenzung zu Kavitationen (Kapitel 6), bei denen mindestens 50% des Volumens mit Luft oder Flüssigkeit gefüllt sein sollten.
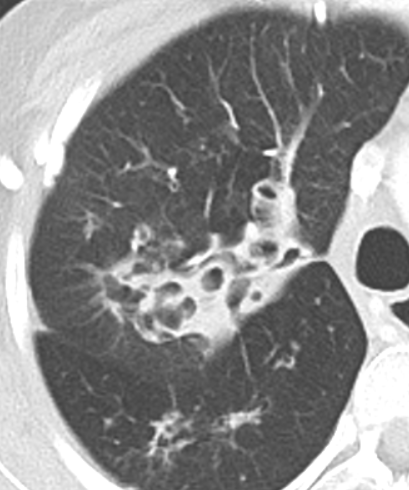
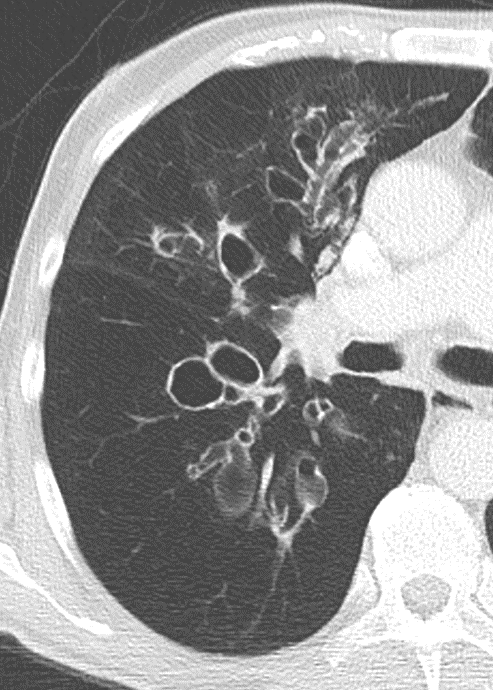
Bronchuswandverdickung
Definition:
- Gesunde Bronchuswände sind hauchdünn und gerade so sichtbar. Verdickte Bronchialwände sehen wie weißer Lippenstift aus und heben die Bronchien damit deutlich vom umliegenden Lungenparenchym ab. Dies kann bei einer Reihe von Erkrankungen wie Entzündung, Fibrose, Degeneration und Ödem, auftreten.
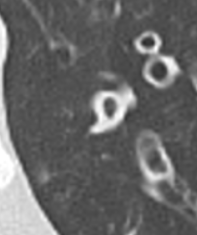
- Der Durchmesser der Bronchien nimmt von zentral nach peripher kontinuierlich ab. Wird er nach peripher hin plötzlich wieder weiter, handelt es sich um eine Bronchiektase. In RACOON wird nicht zwischen Bronchiektasen und Bronchiolektasen unterschieden.
- Die Beurteilung der Verteilung orientiert sich an der Baumarchitektur des Bronchialsystems.
Zusatz:
- Traktionsbronchiektasen entstehen durch die Raffung fibrosierender Prozesse im umliegenden Lungenparenchym. Sie werden daher kaum einmal vorkommen, ohne dass in diesem Lungenareal auch retikuläre Veränderungen zu sehen sind.
- Mucus Plugging entsteht durch endobronchiale Mukusretentionen, die nicht mehr abgehustet werden können. Dies ist typischerweise bei der Mukoviszidose und dort häufig in massiver Ausprägung vorhanden. Aber auch bei allen infektiösen Bronchialerkrankungen können mechanisch verlegte Bronchien, oft mit dahinter unauffällig ventiliertem Lungengewebe, detektiert werden.
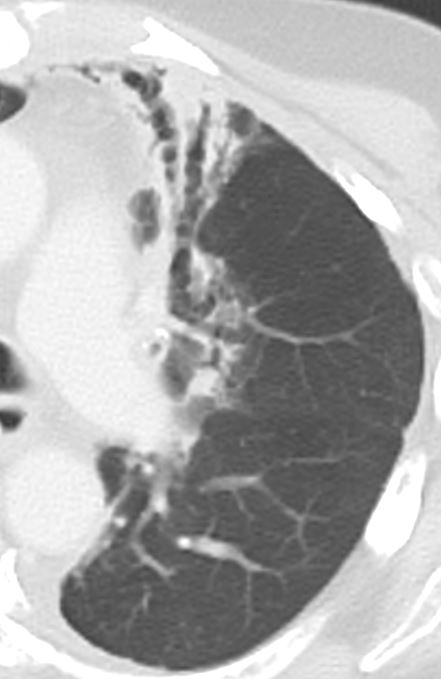
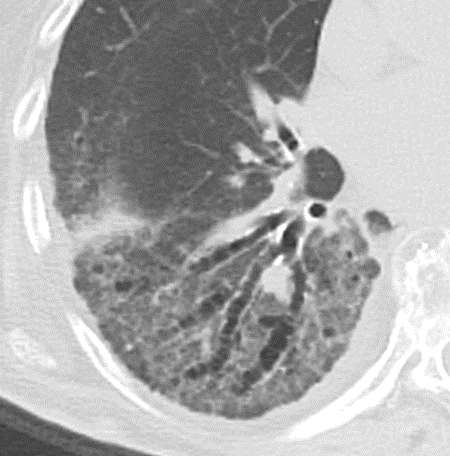
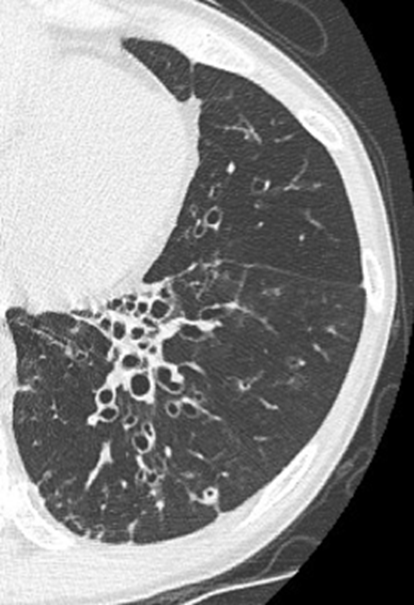
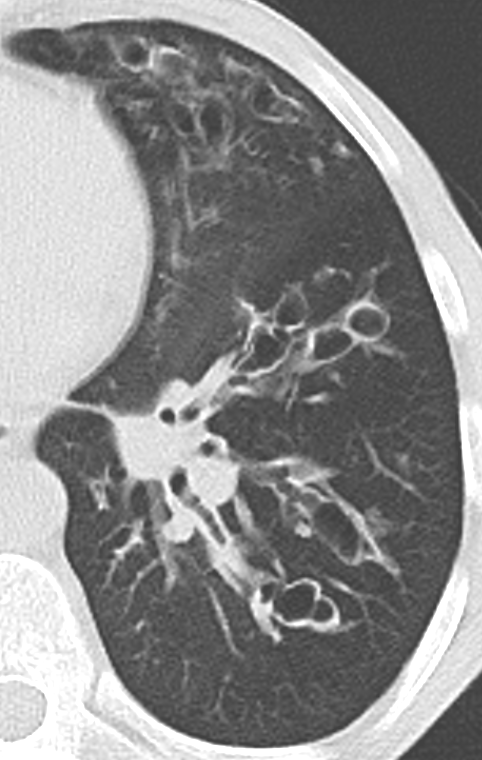
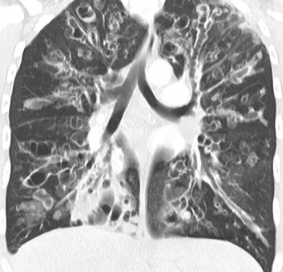
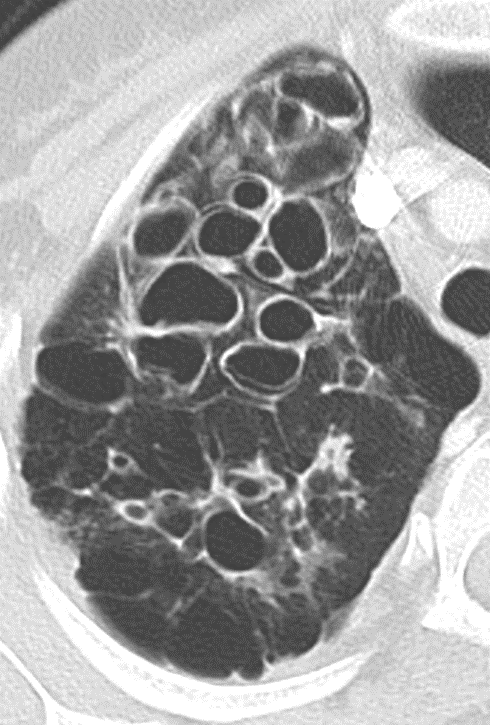
Bronchiektasen
Beschreibungstext identisch zu 10. Bronchuswandverdickung
Definition:
- Gesunde Bronchuswände sind hauchdünn und gerade so sichtbar. Verdickte Bronchialwände sehen wie weißer Lippenstift aus und heben die Bronchien damit deutlich vom umliegenden Lungenparenchym ab. Dies kann bei einer Reihe von Erkrankungen wie Entzündung, Fibrose, Degeneration und Ödem, auftreten.
- Der Durchmesser der Bronchien nimmt von zentral nach peripher kontinuierlich ab. Wird er nach peripher hin plötzlich wieder weiter, handelt es sich um eine Bronchiektase. In RACOON wird nicht zwischen Bronchiektasen und Bronchiolektasen unterschieden.
- Die Beurteilung der Verteilung orientiert sich an der Baumarchitektur des Bronchialsystems.
Zusatz:
- Traktionsbronchiektasen entstehen durch die Raffung fibrosierender Prozesse im umliegenden Lungenparenchym. Sie werden daher kaum einmal vorkommen, ohne dass in diesem Lungenareal auch retikuläre Veränderungen zu sehen sind.
- Mucus Plugging entsteht durch endobronchiale Mukusretentionen, die nicht mehr abgehustet werden können. Dies ist typischerweise bei der Mukoviszidose und dort häufig in massiver Ausprägung vorhanden. Aber auch bei allen infektiösen Bronchialerkrankungen können mechanisch verlegte Bronchien, oft mit dahinter unauffällig ventiliertem Lungengewebe, detektiert werden.
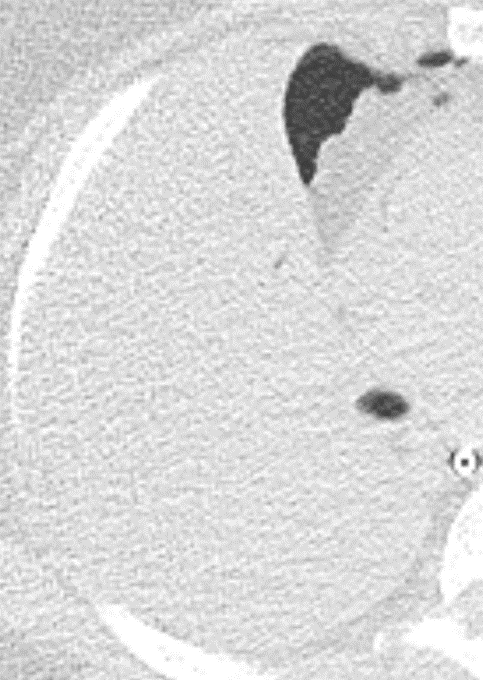
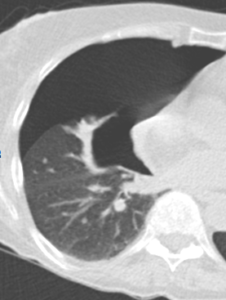
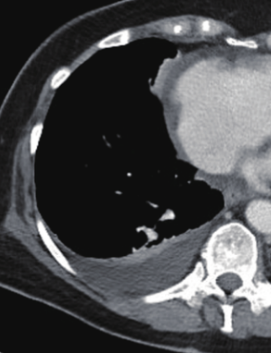
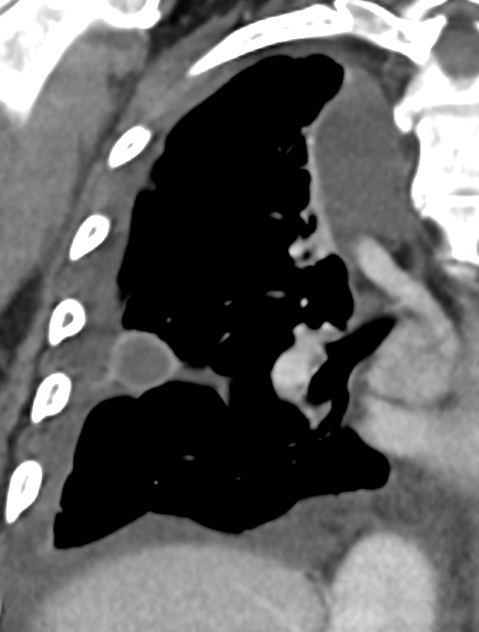
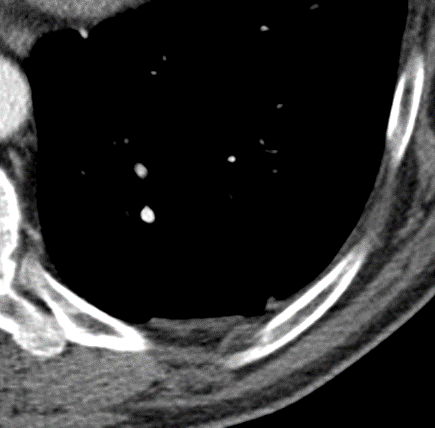
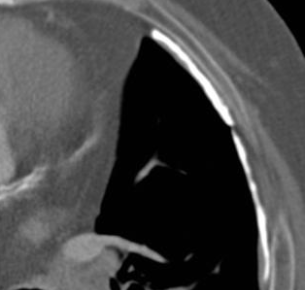
Pneumothorax
Definition:
- Der Schweregrad pleuraler Kollektionen wird im Vergleich mit dem Gesamtvolumen der betroffenen Thoraxhöhle in klein (<10%), mittel (<50%) und groß (>50%) eingeteilt.
- „Pneumothorax“ bezeichnet eine extrapulmonale Luftansammlung im Pleuraspalt. Je nach Druckverhältnis und Größe kann dabei der entsprechende Lungenflügel kollabieren, oder bei einem Ventilmechanismus mit entstehendem Überdruck auch komprimiert werden
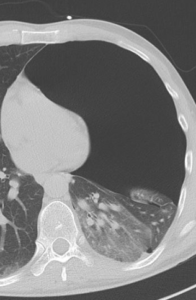
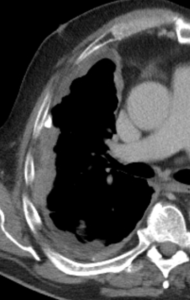
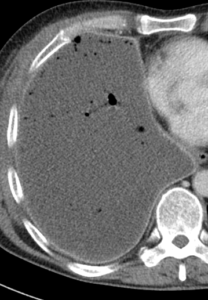
Pleuraerguss
Definition:
- „Pleuraerguss“ bezeichnet Flüssigkeitsansammlungen im Pleuraspalt.
- Der Schweregrad pleuraler Kollektionen wird im Vergleich mit dem Gesamtvolumen der betroffenen Thoraxhöhle in klein (<10%), mittel (<50%) und groß (>50%) eingeteilt.
- Läuft ein Pleuraerguss nicht frei im Pleuraspalt mit einer konkaven Innenseite aus, sondern ist lokalisiert und bikonvex konfiguriert, wird dies als gefangener Pleuraerguss bezeichnet.
- Dichteangehobene Pleuraergüsse >20 HU sollen als hyperdens bewertet werden. Die Dichteerhöhung weist auf eiweißreiche Flüssigkeit, gallige, eitrige oder blutige Beimengungen hin. Weist ein Pleuraerguss eine Dichte >80 HU auf, ist definitiv jodhaltiges Kontrastmittel beteiligt. Diese Frage wurde in RACOON-COMBINE durch eine ROI ersetzt; der Vollständigkeit halber verbleibt die zugehörige Erklärung jedoch im Atlas.
Pleuraerkrankung
Definition:
- Als „Pleuraerkrankung“ bezeichnen wir in RACOON auffällige Verdickungen der Pleura. Münzenförmige, also nummulär flache Verdickungen werden als Plaque bezeichnet. Noduläre Veränderungen entsprechen eher kugelig tumorösen Verdickungen die durch den Ausläufer zur gesunden Pleura hin zumeist einen stumpfen Winkel zum angrenzenden Lungenparenchym formen. Tafelbergartige pleurale Verdickungen imponieren bei orthogonaler Schichtführung wie ein Hochplateau (“Tafelberg”) und sind z.B. bei Asbestosen keine Seltenheit. Flächige pleurale Verdickungen sind großflächig, betreffen also auf einer axialen Schicht mindestens 1/3 der Pleura einer Seite. Ist die Pleura insgesamt verdickt, sollte “generalisiert” ausgewählt werden.
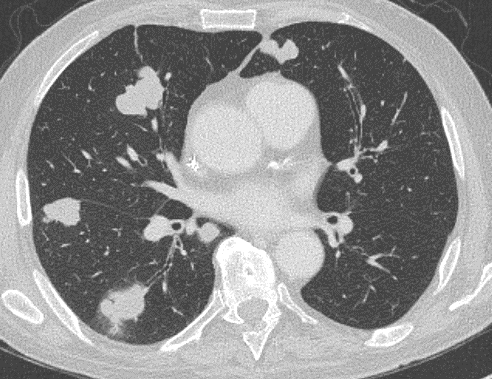
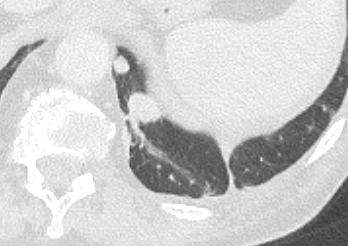
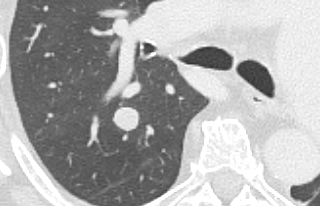
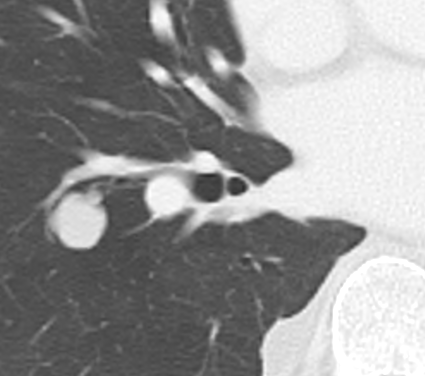
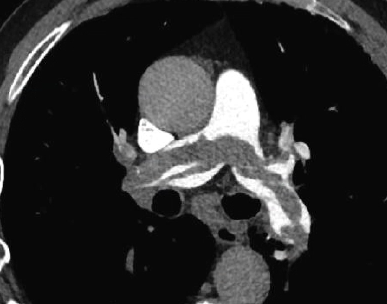
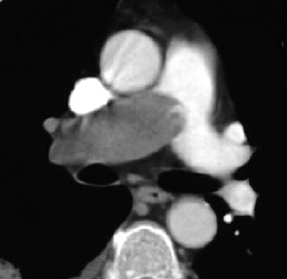
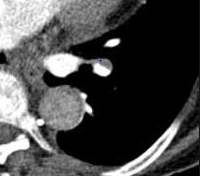
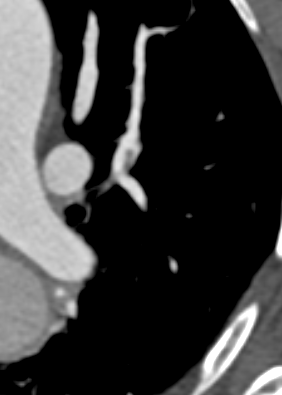
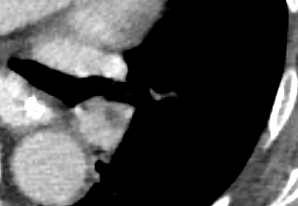
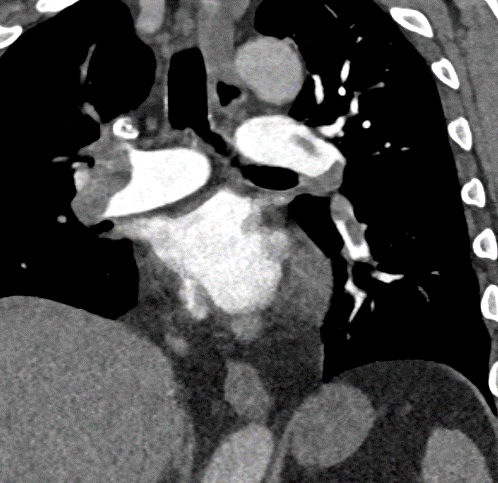
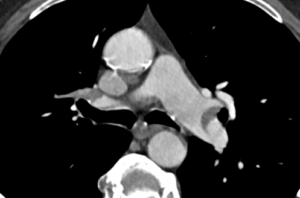
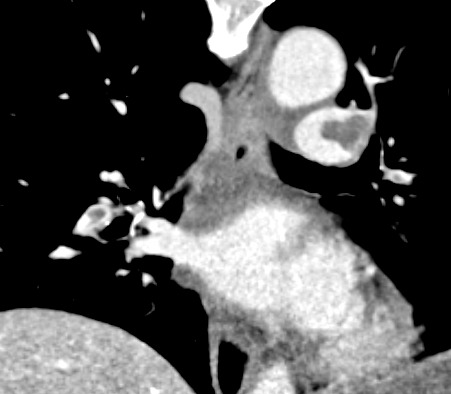
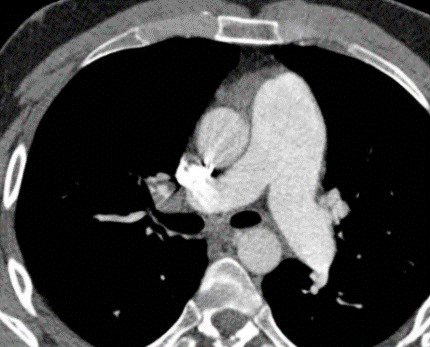
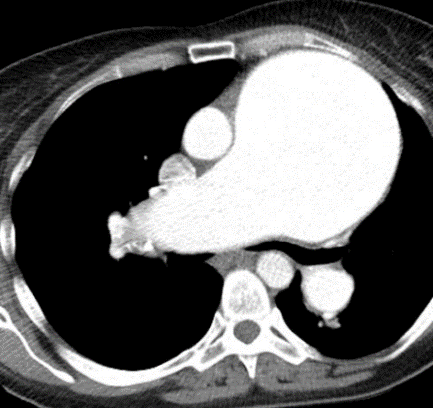
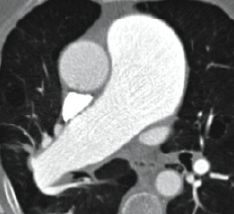
Arterienverschluss
Definition:
- Bei Verschlüssen des Pulmonalarteriensystems wird zwischen zentralen (Truncus, rechter/linker Hauptast, Lobärarterien) und peripheren (Segmentast und alles distal davon) Emboli unterschieden.
- Arterienverschlüsse werden meistens thrombembolisch sein, es werden aber auch Emboli aus Gas, Fett oder Knochenzement beobachtet.
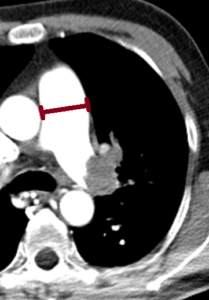
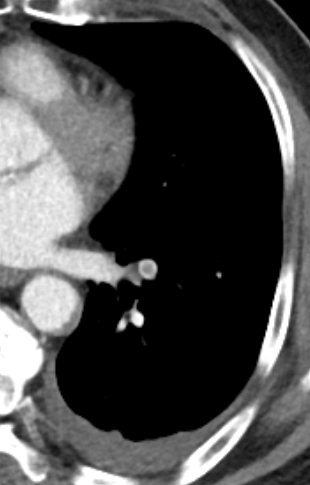
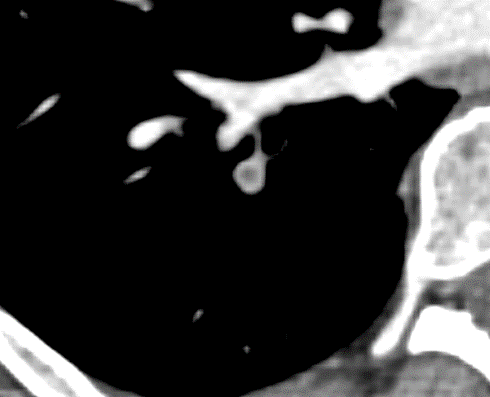
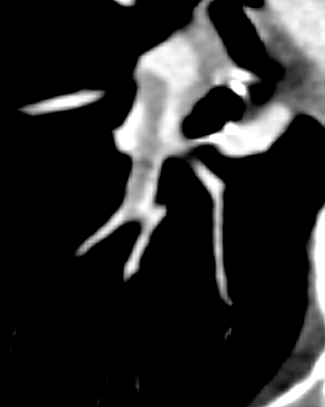
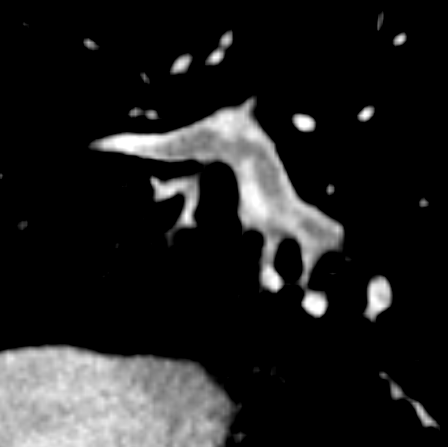
- Eine pathologische Verbreiterung des Truncus pulmonalis kann auf einen pulmonalen Hypertonus hinweisen. Dieser kann idiopathisch auftreten, aber z.B. im Rahmen einer CTEPH auch Folge rezidivierender Thrombembolien sein.
- In RACOON erfolgt eine Einzelmessung des maximalen Durchmessers im axialen Schnittbild.
| Kalkhaltig |
|---|
Kontrastmittelaussparung umspült
Kontrastmittelaussparung wandständig
Winkel zur Arterienwand
Gefäßobliteration
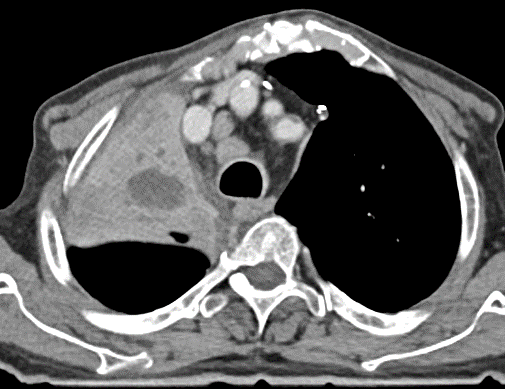
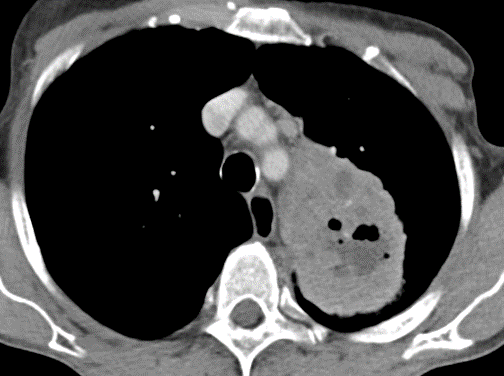
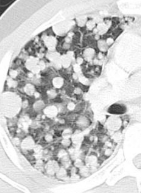
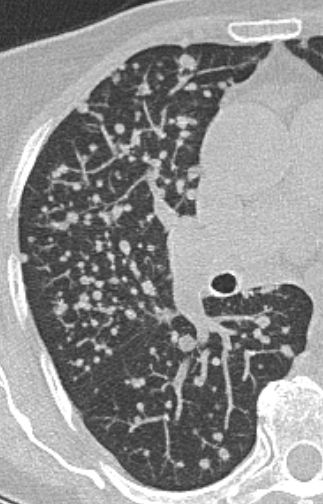
Lymphadenopathie
Definition:
- In RACOON erfolgt lediglich eine einfache Einteilung in hiläre und mediastinale Lymphadenopathie. Dabei sollte die Größe, Menge und die Morphologie berücksichtigt werden. Suspekte Veränderungen sind:
- Lymphknoten mit mehr als 1 cm im kurzen Durchmesser (Azygoslymphknoten >1,5 cm)
- Deutlich vermehrte Anzahl
- Rundliche Konfiguration
- Hilusverlust
- Unscharfe oder spikulierte Berandung
- Dichteminderung oder zentrale Nekrose
- Kontrastmittelaufnahme
Quellenverzeichnis
- Biederer / Reuter, HRCT der Lunge: Noduläre Muster, Radiologe. 2010;50:553-65
- Diederich, Hochauflösende Computertomographie der Lunge: Milchglas und seine Differenzialdiagnosen, Radiologe. 2010;50:1141-52
- Hansell at al, Fleischner Society: glossary of terms for thoracic imaging, Radiology. 2008;246(3):697-722.
- Kauczor et al, Was heißt wie? Ansatz und Glossar zu Befundung und Verständnis in der HRCT der Lunge, RoFo. 1996;165(5):428-37
- Ley-Zaporozhan, Vermehrte Transparenz in der Dünnschicht-CT des Lungenparenchyms, Radiologe. 2011;51:881-95
- Marten, Das retikuläre Muster in der Dünnschicht-CT, Radiologe. 2009;49:873-82
- Reuter / Biederer, Mustererkennung im hochauflösenden Computertomogramm (HRCT) der Lunge, Radiologe. 2009;49:159-72
- Revel et al, COVID-19 patients and the radiology department, Eur Radiol. 2020;30(9):4903-9
- Rossi et al, Tree-in-Bud Pattern at Thin-Section CT of the Lungs, RadioGraphics. 2005;25:789-801
- Wormanns / Hamer, Glossar thoraxradiologischer Begriffe entsprechend der Terminologie der Fleischner Society, Rofo. 2015;187(8):638-61.
- Brant, Helms – Fundamentals of Radiology, 3. Auflage, 2006
- Desai, Devaraj, Lynch, Sverzellati – Webb, Muller and Naidich’s High Resolution of Lung CT, 6. Auflage, 2020
- Gurney – Specialty Imaging: HRCT of the Lung, Amirsys / Elsevier, 2009
- Wormanns – Thoraxdiagnostik, 1. Auflage, Thieme, 2016